AVISO IMPORTANTE
| "As informações fornecidas são baseadas em artigos científicos publicados. Os resumos das doenças são criados por especialistas e submetidos a um processo de avaliação científica. Estes textos gerais podem não se aplicar a casos específicos, devido à grande variabilidade de expressão da doença. Algumas das informações podem parecer chocantes. É fundamental verificar se a informação fornecida é relevante ou não para um caso em concreto. "A informação no Blog Estudandoraras é atualizada regularmente. Pode acontecer que novas descobertas feitas entre atualizações não apareçam ainda no resumo da doença. A data da última atualização é sempre indicada. Os profissionais são sempre incentivados a consultar as publicações mais recentes antes de tomarem alguma decisão baseada na informação fornecida. "O Blog estudandoraras não pode ser responsabilizada pelo uso nocivo, incompleto ou errado da informação encontrada na base de dados da Orphanet. O blog estudandoraras tem como objetivo disponibilizar informação a profissionais de cuidados de saúde, doentes e seus familiares, de forma a contribuir para o melhoramento do diagnóstico, cuidados e tratamento de doenças. A informação no blog Estudandoraras não está destinada a substituir os cuidados de saúde prestados por profissionais. |
domingo, 30 de agosto de 2009
SENSIBILIDADFE QUIMICA MULTIPLA
Transtorno adquirido caracterizado por sintomas recidivantes, relacionado a múltiplos sistemas de órgãos, que ocorre em resposta a exposição de muitos compostos químicos não-relacionados, em doses abaixo daquelas estabelecidas na população geral capazes de causar efeitos danosos. (Tradução livre do original: Cullen MR. The worker with multiple chemical sensitivities: an overview. Occup Med 1987;2(4):655-61).
SINERGISMO E SENSIBILIDADE QUÍMICA MÚLTIPLA
Compreender os possíveis efeitos na saúde associados aos contaminantes do ar em ambientes internos é fundamental para diagnosticar e remediar os problemas de qualidade do ar nestes ambientes. Todos os contaminantes analisados nesta revisão são responsáveis por inúmeros efeitos prejudiciais à saúde. Contudo, existe uma considerável incerteza relacionada ao período de exposição e concentração desses contaminantes para ocasionar problemas de saúde específicos, uma vez que o ser humano reage muito diferentemente à exposição aos poluentes. Além disso, do ponto de vista de diagnóstico, é muito difícil relacionar a exposição, nessas condições, à sintomatologia dos ocupantes dos recintos fechados. Essa é uma área da Epidemiologia e da Clínica Médica que necessita amadurecer.
O desenvolvimento de doenças alérgicas em indivíduos saudáveis é o resultado da interação entre a predisposição genética para reagir com antígenos e a exposição a fatores ambientais. Existem vários estudos na literatura92,93 indicando que fatores ambientais têm um papel fundamental no desenvolvimento de doenças alérgicas em gêmeos idênticos. Em outras palavras, pessoas que são expostas a poluentes no ar interno por um período de tempo mais longo são freqüentemente aquelas mais suscetíveis à poluição em ambientes internos. Tais grupos incluem as crianças, os idosos, e os pacientes que sofrem doenças crônicas, especialmente as respiratórias e cardiovasculares.
Vários poluentes químicos usualmente presentes em ar de ambientes internos, tais como o benzeno e o formaldeído, são agentes carcinogênicos. Os poluentes biológicos podem comportar-se como patogênicos ou alergênicos e, de acordo com seu desenvolvimento, provocam a queda de produtividade ou o absenteísmo. Os ambientes fechados climatizados artificialmente têm como principal fonte de poluição biológica as bandejas de condensação das máquinas de ar condicionado.
Mesmo quando os níveis de contaminantes individuais não representam risco à saúde significativo, pequenas concentrações desses poluentes podem causar um efeito clínico em seres humanos, tendo em vista que a exposição é regular. Esse efeito sinergístico tem sido diagnosticado como "sensibilidade química múltipla".
A sensibilidade química múltipla é uma condição na qual um determinado indivíduo é sensível a um número específico de substâncias químicas, todas em concentrações muito baixas. FIEDLER et al.94 mostraram que os sintomas não são consistentes com as propriedades toxicológicas das substâncias envolvidas, nem com o nível de exposição. Existe muita controvérsia relacionada à questão da sensibilidade química múltipla. Ainda se discute se existe realmente uma doença física, ou se ela é psicossomática.
Recentemente, GÓRSKI et al.95 publicaram um estudo mostrando a ocorrência de um efeito sinergístico entre a presença da fumaça do tabaco (fumante passivo) e concentrações baixas de formaldeído (<25,0-50,0mg/m3), na prevalência de asma.
DENSIBILIDADE QUIMICA MULTIPLA MCS
A sensibilidade química múltipla [MCS (multiple chemical sensitivity)], ainda é uma condição pouco conhecida no Brasil. Todavia, pode estar sob outras denominações como "alergia" ou "hipersensibilidade cruzada" em processos trabalhistas. A polêmica em relação à MCS ocorre por dois fatores: a dificuldade em estabelecer a extensão na qual mecanismos psicológicos ou toxicológicos seriam capazes de causar a sintomatologia; e a controvérsia sobre a existência como uma entidade nosológica distinta. Atualmente, considera-se que MCS seja uma enfermidade: crônica; multissistêmica; recorrente; com quadro clínico similar às primeiras exposições sintomáticas; deflagrada por níveis ínfimos de um número crescente de substâncias químicas, as quais podem não ter relação molecular entre si; e com melhora após a remoção dos agentes desencadeantes. A ausência de alterações clínicas ou laboratoriais que justifiquem o quadro é um critério diagnóstico polêmico, pois alguns pacientes as apresentam. As várias hipóteses fisipatológicas descritivas causaram a criação de inúmeras denominações para MCS. Dentre as hipóteses etiológicas podem-se citar: condicionamento, transtornos fóbico-ansiosos e somatoformes, cacosmia, distúrbio do metabolismo energético, disfunção na transmissão GABAérgica, kindling límbico, reatividade imumológica, inflamação neurogênica, produção de radicais livres, e sensibilização neural.Recentemente uma terceira corrente de autores propôs uma alternativa à dicotomização. Sugerem a possibilidade de uma natureza multifatorial para a MCS, considerando a influência de fatores psicossociais e as interações entre os sistemas nervoso, endócrino e imunológico; além de novas áreas de conhecimento como Ecogenética, Farmacogenética, Epigenética e Neuroimunotoxicologia. Os litígios judiciais em casos de exposição ocupacional a agentes químicos remetem a discussões sobre: a questão mente-corpo; a relação médico-paciente; a extrapolação da toxicidade em animais para humanos; os conflitos de interesse entre governo, indústria e ciência; os fenômenos de histeria de massa; a iatrogenia atribuída à realização de testes psicométricos; o sistema econômico e suas conseqüências na saúde coletiva; e o possível uso ideológico das hipóteses fisiopatológicas. São fatores que podem dificultar a prática do médico do trabalho a escassez de evidências científicas em toxicologia humana e a baixa disponibilidade de treinamento em Neurotoxicologia Ocupacional...(AU)
quarta-feira, 26 de agosto de 2009
SWYER - JAMES

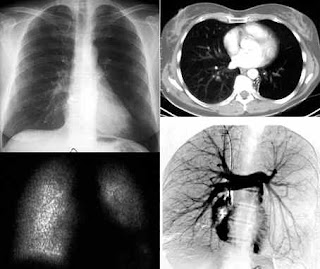


INTRODUÇÃO
A síndrome do pulmão hiperluzente unilateral foi primeiramente
descrita por Swyer e James(1) em um menino de 6
anos de idade em 1953. Desde então, tem sido mais amplamente
conhecida como síndrome de MacLeod(2), após este
autor ter documentado as características radiográficas de hiperluzência
unilateral em 9 pacientes, um ano após o relato
de caso original. Embora de patogênese não inteiramente
compreendida, acredita-se que a condição tipicamente siga a
uma infecção respiratória ocorrida na infância ou adolescência(
3). Repetidas infecções poderiam resultar em bronquiolite
obliterante, o que resultaria gradualmente em alçaponamento
de ar distal, distensão da via aérea e, eventualmente, enfisema
pan-acinar. As áreas afetadas se tornariam hipoventiladas,
com vasoconstrição hipóxica. A clássica hiperluzência
seria, dessa forma, secundária à diminuição do suprimento
sanguíneo nas áreas pulmonares afetada
SINDROME SMITH LEMLI OPITZ
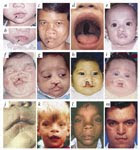


A síndrome de Smith-Lemli-Opitz (SLO) é uma síndrome polimalformativa de natureza metabólica e transmissão
autossómica recessiva, caracterizada por um padrão de dismorfias faciais minor, anomalias congénitas de vários
órgãos, atraso de crescimento e atraso mental. É causada por um defeito da enzima 7-dehidrocolesterol reductase,
responsável pelo último passo da via metabólica da síntese do colesterol. A síndrome de Smith-Lemli-Opitz
caracteriza-se por níveis diminuídos de colesterol e concentrações altas do seu precursor 7-dehidrocolesterol.
Os autores relatam o caso de uma gravidez com rastreio pré-natal integrado positivo para trissomia 21 e níveis séricos
de estriol não conjugado particularmente baixos. O cariótipo fetal revelou uma constituição cromossómica 46,XY.
Ecograficamente havia a registar uma translucência da nuca aumentada às 11 semanas de gestação e, às 18 semanas
ambiguidade genital, encurtamento dos fémures, cardiopatia lábio leporino e atraso de crescimento intra-uterino. A
suspeita bioquímica e ecográfica de síndrome de Smith-Lemli-Opitz foi confirmada pela demonstração de níveis baixos
de colesterol e níveis altos de 7-dehidrocolesterol e 8-dehidrocolesterol no líquido amniótico. Após interrupção médica
da gravidez às 20 semanas, foi realizada a análise mutacional do gene DHCR7 em DNA extraído de tecidos fetais, a
qual demonstrou homozigotia para a mutação comum IVS81G>C associada a fenótipos graves. Os autores fazem
também uma revisão da literatura respeitante ao diagnóstico pré-natal de síndrome de Smith-Lemli-Opitz.
Palavras-chave: Síndrome Smith-Lemli-Opitz, estriol, 7-dehidrocolesterol, colesterol, DHCR7, diagnóstico pré-natal,
translucência da nuca, ambiguidade sexual, IVS81G>C
Cardoso ML et al Diagnóstico Pré-Natal de Síndrome Smith-Lemli-Opitz
23
CASOS CLÍNICOS ISSN 0871-3413 • ©ArquiMed, 2005
Diagnóstico Pré-Natal de Síndrome de Smith-Lemli-Opitz
Maria Luís Cardoso*, Ana Maria Fortuna*, Sérgio Castedo†, Margarida Martins‡, Nuno Montenegro§,
Cornelis JakobsII, Peter Clayton**, Laura Vilarinho*
*Instituto de Genética Médica Jacinto de Magalhães, Porto; †GDPN-Genética Médica e Diagnóstico Pré-Natal, Porto;
‡Serviço de Obstetrícia , Hospital Pedro Hispano, Matosinhos; §Departamento de Ginecologia e Obstetrícia, Hospital
de São João, Porto; IIMetabolic Unit, Departement of Clinical Chemistry, VU University Medical Centre, Amsterdam,
The Netherlands; **Biochemistry Unit, Institute of Child Health, England
ARQUIVOS DE MEDICINA, 19(1-2): 23-27
INTRODUÇÃO
A síndrome de Smith-Lemli-Opitz (SLO, OMIM 270400)
é uma doença genética da biossíntese do colesterol de
transmissão autossómica recessiva caracterizada por
um padrão de dismorfias faciais minor (ptose, narinas
antevertidas, micrognatia, fenda palatina, úvula bífida),
alterações dos membros (sindactilia do segundo e terceiro
dedos dos pés, polidactilia pós-axial) e malfomações
congénitas múltiplas incluindo pseudohermafrodismo no
sexo masculino, hipolobulação pulmonar, agenesia renal,
malformações cardíacas e cerebrais bem como
atraso crescimento, hipotonia neonatal e atraso mental
(1). Estima-se que a sua incidência possa variar entre
1:22 000 (2) e 1:60 000 (3) consoante as populações.
Na origem da doença está um défice da enzima 7-
dehidrocholesterol reductase (EC 1.3.1.21) codificada
pelo gene DHCR7, localizado no cromossoma 11q13,
responsável pela conversão de 7-dehidrocolesterol em
colesterol (4,5). Este bloqueio tem consequências graves
para o desenvolvimento intra-uterino fetal, dadas as
múltiplas funções biológicas desempenhadas por este
lípido neutro.
No passado foram descritas duas formas de síndrome
de Smith-Lemli-Opitz com base no fenótipo clínico
observado: o tipo II correspondente a uma apresentação
grave e incompatível com a vida e o tipo I que inclui os
fenótipos menos graves da patologia. Contudo, as bases
bioquímicas e moleculares são as mesmas e os fenótipos
traduzem simplesmente diferentes níveis de actividade
enzimática residual (6).
Os autores apresentam um caso de diagnóstico prénatal
(DPN) de síndrome de Smith-Lemli-Opitz às 19
semanas de gravidez, numa família sem história positiva,
com base na detecção de níveis diminuídos de colesterol
no líquido amniótico (LA) e presença dos seus precursores
7-dehidrocolesterol e de 8-dehidrocolesterol bem como
a sua confirmação molecular. Os autores revêem também
o estado actual do conhecimento no que se refere
diagnóstico pré-natal de síndrome de Smith-Lemli-Opitz.
A síndrome de Smith-Lemli-Opitz (SLO) é uma síndrome polimalformativa de natureza metabólica e transmissão
autossómica recessiva, caracterizada por um padrão de dismorfias faciais minor, anomalias congénitas de vários
órgãos, atraso de crescimento e atraso mental. É causada por um defeito da enzima 7-dehidrocolesterol reductase,
responsável pelo último passo da via metabólica da síntese do colesterol. A síndrome de Smith-Lemli-Opitz
caracteriza-se por níveis diminuídos de colesterol e concentrações altas do seu precursor 7-dehidrocolesterol.
Os autores relatam o caso de uma gravidez com rastreio pré-natal integrado positivo para trissomia 21 e níveis séricos
de estriol não conjugado particularmente baixos. O cariótipo fetal revelou uma constituição cromossómica 46,XY.
Ecograficamente havia a registar uma translucência da nuca aumentada às 11 semanas de gestação e, às 18 semanas
ambiguidade genital, encurtamento dos fémures, cardiopatia lábio leporino e atraso de crescimento intra-uterino. A
suspeita bioquímica e ecográfica de síndrome de Smith-Lemli-Opitz foi confirmada pela demonstração de níveis baixos
de colesterol e níveis altos de 7-dehidrocolesterol e 8-dehidrocolesterol no líquido amniótico. Após interrupção médica
da gravidez às 20 semanas, foi realizada a análise mutacional do gene DHCR7 em DNA extraído de tecidos fetais, a
qual demonstrou homozigotia para a mutação comum IVS81G>C associada a fenótipos graves. Os autores fazem
também uma revisão da literatura respeitante ao diagnóstico pré-natal de síndrome de Smith-Lemli-Opitz.
Palavras-chave: Síndrome Smith-Lemli-Opitz, estriol, 7-dehidrocolesterol, colesterol, DHCR7, diagnóstico pré-natal,
translucência da nuca, ambiguidade sexual, IVS81G>C
ARQUIVOS DE MEDICINA Vol. 19, Nº 1-2
24
CASO CLÍNICO E MÉTODOS
Casal jovem saudável não consanguíneo com história
familiar e clínica irrelevante (gesta -1, para- 0). A primeira
ecografia efectuada às 11 semanas de gestação revelou
uma translucência da nuca (TN) aumentada (4mm). O
rastreio pré-natal integrado para síndrome de Down (7),
revelou um risco aumentado de síndrome de Down 1 em
18, a termo, trissomia 18 de 1 em 220 e um risco de
síndrome de Smith-Lemli-Opitz de 1 em 20, baseado nos
valores da translucência da nuca e dos níveis dos
seguintes marcadores: às 11 semanas e 5 dias PAPP-A
de 0.58 múltiplos da mediana (MoM) e, às 14 semanas e
5 dias, α-fetoproteína de 1.03 MoM, estriol não conjugado
(uE3) de 0.29 MoM, fracção β da gonadotrofina coriónica
humana livre (β-hCG) de 0.42 MoM e inibina-A de 1.21
MoM. Foi usado o programa Alpha (Logical Medical
Systems, Ltd) para os cálculos de risco.
Amniocentese foi efectuada às 14 semanas e 5 dias,
e a análise citogenética dos amniócitos cultivados revelou
um cariótipo normal 46,XY. A ecografia morfológica, às
18 semanas, revelou um atraso de crescimento intrauterino,
lábio leporino bilateral, ambiguidade sexual,
encurtamento dos fémures e cardiopatia. A
ecocardiografia fetal confirmou a existência de
comunicação inter-auricular/aurícula única.
A análise conjunta dos estudos efectuados e dos
resultados encontrados sugeriu como hipótese de
diagnóstico mais provável a síndrome de Smith-Lemli-
Opitz. Procedeu-se então à análise cromatográfica dos
esteróis no sobrenadante do líquido amniótico (que tinha
sido colhido para cariótipo e conservado congelado
a -20ºC). A metodologia utilizada corresponde à adaptação
de protocolos descritos na literatura (8). Este estudo
revelou a existência de níveis diminuídos colesterol (6
mmol /L; controlos normais: 9 - 23 mmol/L) bem como a
Fig. 1 - Análise dos esteróis do líquido amniótico por cromatografia de fase gasosa com espectrometria de massa em
modo de ião selectivo.A – Líquido amniótico normal; B – Líquido amniótico positivo para Síndrome Smith-Lemli-Opitz.
Esteróis identificados: 1) padrão interno – epicoprostanol; 2) colesterol; 3) 8-dehidrocolesterol; 4) 7-dehidrocolesterol.
Cardoso ML et al Diagnóstico Pré-Natal de Síndrome Smith-Lemli-Opitz
25
presença de 7-dehidrocolesterol (7,5 mmol /L; controlos
normais: <>C.
Seguidamente foi feito aconselhamento genético ao
casal, tendo-lhes sido explicado o risco de recorrência de
25%. Cerca de ano e meio depois, o casal recorreu à
consulta por nova gravidez de 17 semanas, tendo sido
oferecido diagnóstico pré-natal específico para síndrome
de Smith-Lemli-Opitz que revelou um feto não afectado.
DISCUSSÃO
O colesterol é o principal esterol dos tecidos humanos.
Este lípido neutro tem duas origens: é fornecido pela
alimentação e é sintetizado in vivo através de uma via
metabólica complexa. A maior parte do colesterol
necessário ao desenvolvimento fetal é produzido pelo
próprio feto (9,10). Assim, um défice na biossíntese do
colesterol constitui um erro hereditário do metabolismo
com expressão pré-natal, manifestando-se habitualmente
através de malformações várias que reflectem a
importância das funções que o colesterol desempenha
no organismo (11).
O diagnóstico pré-natal assenta na conjugação de
metodologias que permitam pôr em evidência a dupla
faceta desta patologia: (i) a síndrome polimalformativa e
(ii) as alterações metabólicas.
Ecografia
Na suspeição de um caso de síndrome de Smith-
Lemli-Opitz a ecografia constitui como um exame
importante, permitindo detectar alterações no
desenvolvimento fetal.
De acordo com um trabalho recente de análise
retrospectiva de 30 casos (12), as manifestações antenatais
desta patologia incluem: (i) no primeiro trimestre,
aumento da translucência da nuca em cerca de 26% dos
casos, (ii) no segundo trimestre (entre as 20 e 22 semanas)
edema da nuca (26%), malformações renais (26%),
polidactilia (10%), ambiguidade sexual (6%),
malformações cerebrais (10%), malformações cardíacas
(10%) e ACIU (20%), (iii) na ecografia de terceiro
trimestre (30 - 34 semanas) ACIU em 46% dos casos,
pelo que este constitui a manifestação ante-natal mais
frequente de síndrome de síndrome de Smith-Lemli-
Opitz identificada. Só em 6% dos casos referidos foi
possível detectar um conjunto de cinco anomalias,
configurando uma apresentação típica, que orientou
fortemente o diagnóstico e em 16% dos casos todas as
ecografias efectuadas foram consideradas normais (12).
Estes dados demonstram que o diagnóstico ecográfico é
por si só insuficiente e que por vezes as malformações
presentes são subtis, não sendo detectadas no período
pré-natal.
No caso que relatamos a associação de translucência
da nuca aumentada (no rastreio do primeiro trimestre)
com um conjunto de anomalias que incluíam ACIU,
ambiguidade sexual, lábio leporino, encurtamento dos
membros e comunicação intra-auricular constituiam
indicação para realização de amniocentese para
diagnóstico de uma eventual anomalia cromossómica.
Estriol não conjugado
O facto de a mãe ter efectuado o rastreio bioquímico,
foi também um aspecto determinante para a efectivação
deste diagnóstico: um valor baixo de estriol livre (0,29
MoM) combinado com as alterações ecográficas é
altamente sugestivo de uma alteração na
esteroidogénese. Esta associação explica-se pelo facto
de os défices na síntese do colesterol originarem
hipocolesterolemia fetal com diminuição na quantidade
de colesterol disponível para a síntese de estriol (que se
apresentará baixo), para a construção de membranas
celulares essencial num período de divisão celular intensa
e para interagir com as proteínas sonic hedgehog
moduladoras da embriogénese que se sabe serem
activadas pelo colesterol (dando por conseguinte origem
a ACIU e malformações). Pelas mesmas razões um
estriol normal poderá ser encontrado nas formas ligeiras
da síndrome (13).
De acordo com alguns autores a combinação de
rastreios bioquímicos pré-natais que incluam o
doseamento de estriol livre no sangue materno com uma
vigilância ecográfica cuidada virão no futuro ajudar no
diagnóstico de mais casos desta síndrome (12,14). A
maior dificuldade encontra-se na definição de critérios
globalmente aceites na selecção dos casos suspeitos e
que deverão ser testados para 7-dehidrocolesterol. Com
base na sua experiência há vários autores (14-16) que
sugerem que se testem para síndrome de Smith-Lemli-
Opitz as gestações em que se verifiquem simultaneamente
as três condições seguintes:
1. Marcadores séricos maternos sugestivos de risco
aumentado para trissomia 18 ou 21 (com registo de
estriol baixo).
2. Cariótipo normal.
3. Alterações ecográficas.
De acordo com este critério, o nosso caso teria sido
seleccionado para estudos complementares, permitindo
o diagnóstico.
Isoladamente, os níveis baixos de estriol livre não
constituem um bom indicador na selecção de casos para
diagnóstico pré-natal de síndrome de Smith-Lemli-Opitz
(3,13,17) pois existem outras causas mais frequentes às
quais se pode imputar essa situação, nomeadamente:
morte fetal, anencefalia, hipoplasia congénita das supraARQUIVOS
DE MEDICINA Vol. 19, Nº 1-2
26
renais e défice em sulfatase dos esteróides entre outras
(3,17).
Ensaios bioquímicos específicos
Até à descoberta do defeito metabólico responsável
pela síndrome de Smith-Lemli-Opitz, o diagnóstico prénatal
disponibilizado às famílias (com uma criança
afectada previamente diagnosticada) era efectuado por
ecografia. A partir do momento em que as bases
bioquímicas da síndrome de Smith-Lemli-Opitz foram
esclarecidas, esta situação alterou-se (4) e foram
efectuados estudos retrospectivos, para estabelecer
metodologias laboratoriais destinadas ao diagnóstico
pré-natal prospectivo de casos de risco (8,16). As mais
utilizadas consistem no doseamento dos esteróis
presentes no líquido amniótico (8,16,18,19), podendo
também efectuar-se a determinação da actividade
enzimática da 7-dehidrocolesterol reductase em
vilosidades coriónicas ou amniócitos cultivados (20),
embora seja uma abordagem mais onerosa e demorada.
É possível que no futuro teste de eleição seja de natureza
não invasiva através da identificação de esteróis
“anómalos” (derivados do 7-dehidrocolesterol) na urina
materna (21).
No caso que descrevemos, o diagnóstico pré-natal de
síndrome de Smith-Lemli-Opitz foi feito mediante a
determinação dos níveis de 7-dehidrocolesterol e
8-dehidrocolesterol no líquido amniótico por cromatografia
gasosa com espectrometria de massa em módulo de ião
selectivo por ser uma metodologia altamente sensível.
Verificou-se que o colesterol (principal esterol dos
mamíferos) estava baixo 6μmol /L e que o seu precursor
7-dehidrocolesterol apresentava uma concentração
elevada (sendo superior à do próprio colesterol -
7,5μmol /L). Estes dados favorecem a hipótese de
estarmos perante um défice enzimático severo, a qual é
reforçada pela positividade do teste efectuado sobre
líquido amniótico colhido às 14 semanas de gestação
quando a indicação mais comum é da sua execução após
as 18 semanas, para diminuição do risco de falsos
negativos por baixa concentração dos compostos
marcadores.
Estudos moleculares
Com a clonagem e localização cromossómica do
gene DHCR7 em 11q12-13 (22-24) tornou-se possível
conhecer o espectro mutacional responsável pela
síndrome de Smith-Lemli-Opitz em diferentes populações
e foram ensaiadas algumas tentativas de correlação
genótipo-fenótipo (25,26). Além disso tornou-se possível
o diagnóstico pré-natal molecular de síndrome de Smith-
Lemli-Opitz com base na identificação de mutações no
gene DHCR7 (27-30).
No nosso caso a análise mutacional só foi efectuada
após o diagnóstico bioquímico de síndrome de Smith-
Lemli-Opitz e revelou um feto homozigótico para a
mutação IVS8-1G>C, a mais frequente nos caucasianos.
Esta é uma mutação nula, conduzindo à inexistência de
enzima activa pelo que o fenótipo que lhe está associado
é extremamente grave e incompatível com a vida. Este é
o sétimo caso com homozigotia para esta mutação referido
na literatura (23,25,28) no entanto é provável que dada a
elevada mortalidade peri-natal associada a homozigotia
para mutações nulas, esta situação esteja subvalorizada.
Vários autores defendem que na autópsia de fetos
com malformações múltiplas seja incluído para além do
estudo genético a análise dos esteróis se a síndrome de
Smith-Lemli-Opitz é minimamente suspeito (6). A
investigação molecular pode também ser efectuada em
amostras de DNA extraído de produtos de abortamento
ou placentas de fetos com malformações em que a
fetopatologia equacione a hipótese de síndrome de Smith-
Lemli-Opitz e não existam produtos adequados para
análise bioquímica (31).
CONCLUSÃO
Este foi o primeiro diagnóstico pré-natal positivo para
síndrome de Smith-Lemli-Opitz, completamente
caracterizado (em termos, bioquímicos e moleculares)
em Portugal numa família sem história prévia de
abortamentos ou de fetos com malformações.
Este caso ilustra bem a ideia de que o diagnóstico prénatal
de síndrome de Smith-Lemli-Opitz deve ser
considerado, em termos prospectivos, nas gestações em
que houver registo de anomalias ecográficas e que
cursem com um estriol baixo no rastreio bioquímico
materno do segundo trimestre.
Dado que por vezes as malformações só são
detectadas tardiamente, e nalguns casos a amniocentese
pode ter sido realizada algumas semanas antes, é
necessário que se introduza de modo mais sistemático a
prática de separar, congelar e conservar cerca de 3 ml de
sobrenadante do líquido amniótico, para eventuais ensaios
bioquímicos que venham a ser necessários, tal como
ocorreu no presente caso.
Deve ser sublinhado que, face ao estado actual do
conhecimento, só conseguimos diagnosticar
prospectivamente casos de síndrome de Smith-Lemli-
Opitz com fenótipo moderado a grave. O diagnóstico prénatal
de formas ligeiras continua a só ser possível quando
existe um caso índex caracterizado. Nestas variantes
menos graves os níveis de colesterol estão muitas vezes
no limiar da normalidade, pelo que os níveis de estriol
serão normais e as malformações minor presentes podem
não ser detectadas na ecografia fetal convencional.
Cardoso ML et al Diagnóstico Pré-Natal de Síndrome Smith-Lemli-Opitz
27
Correspondência:
Dr.ª Maria Luís Cardoso
Unidade de Biologia Clínica
Instituto de Genática Mádica Jacinto Magalhães
Praça Pedro Nunes, 88
4099-028 Porto
e-mail: mluiscardoso@gm.min-saude.pt
REFERÊNCIAS
1 - Smith DW, Lemli L, Opitz JA. A newly recognized syndrome
of multiple congenital anomlies. J Pediatr 1964;64:210-7
2 - Wayne JS, Nakamura LM, Eng B, Hunnisett L, Chitayat D,
Costa T, Nowaczyk MJM. Smith-Lemli-Opitz syndrome:
carrier frequency and spectrum of DHCR7 mutations in
Canada. J Med Genet 2002;39;e31
3 - Schoen E, Norem C, O’ Keefe J, Krieger R, Walton D, To TT.
Maternal Serum Unconjugated Estriol as a Predictor for
Smith-Lemli-Opitz Syndrome and Other Fetal Conditions.
Obstet & Gynecol 2003;102:167-72
4 - Tint GS, Irons M, Elias ER, Batta AK, Frieden R, Chen T,
Salen G. Defective Cholesterol Biosynthesis Associated
with the Smith-Lemli-Opitz syndrome. New Engl J Med
1994;330:107-13
5 - Waterham HR, Wanders RJA. Biochemical and genetic
aspects of 7-dehydrocholesterol reductase and Smith-Lemli-
Opitz. Biochim Biophys Acta 2000;1529:340-56
6 - Seller MJ, Russell J, Tint GS. Unusual Case of Smith-Lemli-
Opitz Syndrome “Type II”. Am J Hum Genet 1995;56:265-8
7 - Wald NJ, Watt HC, Hackshaw AK. Integrated screening for
Down’s syndrome on the basis of tests performed during the
first and second trimesters. N Engl J Med 1999;341:461-7.
8 - Kelley RI. Diagnosis of Smith-Lemli-Opitz syndrome by gas
chromatography/mass spectrometry of 7-dehydrocholesterol
in plasma, amniotic fluid and cultured skin fibroblasts.
Clin Chim Acta 1995;236:45-58
9 - Connor WE, Lin DS. Placental transfer of cholesterol - 4-14C
into rabbit and guinea pig fetus. J Lipid Res 1967;8:558-64
10 - Schmid KE. Endogenous and Exogenous Sources of
Cholesterol During Fetal Development. PhD thesis in
Pathobiology and Molecular Medicine, University of Cincinnati,
2003
11 - Clayton PT. Disorders of Cholesterol biosynthesis. Arch Dis
Child 1998;78:185-189
12 - Goldenberg A, Wolf C, Chevy F, Benachi A, Dumez Y,
Munnich A, Cormier-Daire V. Antenatal manifestations of
Smith-Lemli-Opitz (RSH) Syndrome : A retrospective Survey
of 30 cases. Am J Med Genet 2004;124A:423-6
13 - Kratz LE, Kelley RI. Prenatal diagnosis of the RSH / Smith-
Lemli-Opitz syndrome. Am J Med Genet 1999;82:376-81
14 - Angle B, Tint GS, Yacoub OA, Clark AL. Atypical case of
Smih-Lemli-Opitz Syndrome: Implications for diagnosis. Am
J Med Genet 1998;80:322-6
15 - Canick JA, Abuelo DN, Bradley LA Tint GS. Maternal serum
marker levels in two pregnanacies affected with Smith-
Lemli-Opitz syndrome. Prenat Diagn 1997;17:187-9
16 - Rossiter JP, Hofman KJ, Kelley RI. Smih-Lemli-Opitz
Syndrome: Prenatal Diagnosis by Quantification of Cholesterol
Precursors in Amniotic Fluid. Am J Hum Genet
1995;56:272-5
17 - Bick DP, McCorkle D, Stanley WS, Stern HJ, Staszak P,
Berkovitz GD et al. Prenatal Diagnosis of Smith-Lemli-Opitz
Syndrome in a pregnancy with Low Maternal Serum Oestriol
and a Sex-reversed fetus. Prenat Diagn 1999;19:68-71
18 - Abuelo DN, Tint GS, Kelley R, Batta AK, Shefer S, Salen G.
Prenatal Detection of the cholesterol Biosynthetic Defect in
the Smith-Lemli-Opitz syndrome by the Analysis of Amniotic
Fluid Sterols. Am J Med Genet 1995;56:281-5
19 - Dallaire L, Mitchell G, Giguère R, Lefebvre F, Melançon SB,
Lambert M. Prenatal diagnosis of Smith-Lemli-Opitz syndrome
is possible by measurement of 7-dehydrocholesterol
in amniotic fluid. Prenat Diagn 1995;15:855-8
20 - Linck LM, Hayflick SJ, Lin DS, Battaile KP, Ginat S,
Burlingame T, et al. Fetal demise with Smith-Lemli-Opitz
syndrome confirmed by tissue sterol analysis and the absence
of measurable 7-dehydrocholesterol Δ7-reductase
activity in chorionic villi. Prenat Diagn 2000;20:238-40
21 - Shackleton C, Roitman E, Kratz L, Kelley R. Dehydrooestriol
and dehydropregnanetriol are candidate analyse for
prenatal diagnosis of Smith-Lemli-Opitz syndrome. Prenat
Diagn 2001;21:207-12.
22 - Wassif CA, Maslen C, Kachilele-Linjewile S, Lin D, Linck
LM, Connor WE. Mutations in the human sterol Δ-7-reductase
gene at 11q12-13 cause Smith-Lemli-Opitz syndrome.
Am J Hum Genet 1998;63:55-62
23 - Waterham HR, Wijburg FA, Hennekam RC, Vreken P, Poll-
The BT, Dorland L, et al. Smith-Lemli-Opitz syndrome is
caused by mutations in the 7-dehydrocholesterol reductase
gene. Am J Hum Genet 1998;63:329-38
24 - Fitzky BU, Witsch-Baumgartner M, Erdel M, Lee JN, Paik
Y-K, Glossmann H et al. Mutations in the Δ-7-sterol reductase
gene in patients with the Smith-Lemli-Opitz syndrome.
Proc. Natl Acad Sci USA 95:8181-8186
25 - Witsch-Baumgartner M, Fitzky BU, Ogorelkova M, Kraft
HG, Moebius FF, Glossmann H et al. Mutational spectrum
in the delta 7-sterol reductase gene and genotype-phenotype
correlation in 84 patients with Smith-Lemli-Opitz syndrome.
Am J Hum Genet 2000;66:402-12
26 - Goldenberg A, Chevy F, Bernard C, Wolf C, Cormier-Daire
V. Circonstances cliniques du diagnostique du syndrome de
Smith-Lemli-Opitz et tentatives de corrélation phénotypegenótype:
à propos de 45 casirconstances cliniques du
diagnostique du syndrome de Smith-Lemli-Opitz et tentatives
de corr 84 patients with Smith-Lemli-Opit. Arch Pediatr
2003;10:4-10
27 - Bzdúch V, Kozák L, Franvová H, Behúlová D. Prenatal
Diagnosis of Smith-Lemli-Opitz syndrome by Mutation Analysis.
Am J Med Genet 2000;95:85
28 - Nowaczyk MJM, Farrell SA, Sirkin WL, Velsher L, Krakowiak
PA, Waye JS, Porter FD. Smith-Lemli-Opitz (RHS) Syndrome:
Holoprosencephaly and Homozygous IVS8-1G_C
Genotype Am J Med Genet 2001;103:75-80
29 - Nowaczyk MJM, Garcia DM, Eng B, Waye J. Rapid
Molecular Prenatal Diagnosis of Smith-Lemli-Opitz Syndrome.
Am J Med Genet 2001;102:287-388
30 - Löffler J, Utermann G, Witsch-Baumgartner M. Molecular
prenatal diagnosis of Smith-Lemli-Opitz syndrome is reliable
and efficient. Prenat Diagn 2002;22:827-30
31 - Löffler J, Trojovsky A, Casati B, Kroisel PM, Utermann G.
Homozygosity for the W151X Stop Mutation in the Δ7-sterol
Reductase Gene (DHCR7) Causing a Lethal Form of Smith-
Lemli-Opitz syndrome: Retrospective Molecular Diagnosis.
Am J Med Genet 2000;95:174-7
REFERÊNCIAS
1 - Smith DW, Lemli L, Opitz JA. A newly recognized syndrome
of multiple congenital anomlies. J Pediatr 1964;64:210-7
2 - Wayne JS, Nakamura LM, Eng B, Hunnisett L, Chitayat D,
Costa T, Nowaczyk MJM. Smith-Lemli-Opitz syndrome:
carrier frequency and spectrum of DHCR7 mutations in
Canada. J Med Genet 2002;39;e31
3 - Schoen E, Norem C, O’ Keefe J, Krieger R, Walton D, To TT.
Maternal Serum Unconjugated Estriol as a Predictor for
Smith-Lemli-Opitz Syndrome and Other Fetal Conditions.
Obstet & Gynecol 2003;102:167-72
4 - Tint GS, Irons M, Elias ER, Batta AK, Frieden R, Chen T,
Salen G. Defective Cholesterol Biosynthesis Associated
with the Smith-Lemli-Opitz syndrome. New Engl J Med
1994;330:107-13
5 - Waterham HR, Wanders RJA. Biochemical and genetic
aspects of 7-dehydrocholesterol reductase and Smith-Lemli-
Opitz. Biochim Biophys Acta 2000;1529:340-56
6 - Seller MJ, Russell J, Tint GS. Unusual Case of Smith-Lemli-
Opitz Syndrome “Type II”. Am J Hum Genet 1995;56:265-8
7 - Wald NJ, Watt HC, Hackshaw AK. Integrated screening for
Down’s syndrome on the basis of tests performed during the
first and second trimesters. N Engl J Med 1999;341:461-7.
8 - Kelley RI. Diagnosis of Smith-Lemli-Opitz syndrome by gas
chromatography/mass spectrometry of 7-dehydrocholesterol
in plasma, amniotic fluid and cultured skin fibroblasts.
Clin Chim Acta 1995;236:45-58
9 - Connor WE, Lin DS. Placental transfer of cholesterol - 4-14C
into rabbit and guinea pig fetus. J Lipid Res 1967;8:558-64
10 - Schmid KE. Endogenous and Exogenous Sources of
Cholesterol During Fetal Development. PhD thesis in
Pathobiology and Molecular Medicine, University of Cincinnati,
2003
11 - Clayton PT. Disorders of Cholesterol biosynthesis. Arch Dis
Child 1998;78:185-189
12 - Goldenberg A, Wolf C, Chevy F, Benachi A, Dumez Y,
Munnich A, Cormier-Daire V. Antenatal manifestations of
Smith-Lemli-Opitz (RSH) Syndrome : A retrospective Survey
of 30 cases. Am J Med Genet 2004;124A:423-6
13 - Kratz LE, Kelley RI. Prenatal diagnosis of the RSH / Smith-
Lemli-Opitz syndrome. Am J Med Genet 1999;82:376-81
14 - Angle B, Tint GS, Yacoub OA, Clark AL. Atypical case of
Smih-Lemli-Opitz Syndrome: Implications for diagnosis. Am
J Med Genet 1998;80:322-6
15 - Canick JA, Abuelo DN, Bradley LA Tint GS. Maternal serum
marker levels in two pregnanacies affected with Smith-
Lemli-Opitz syndrome. Prenat Diagn 1997;17:187-9
16 - Rossiter JP, Hofman KJ, Kelley RI. Smih-Lemli-Opitz
Syndrome: Prenatal Diagnosis by Quantification of Cholesterol
Precursors in Amniotic Fluid. Am J Hum Genet
1995;56:272-5
17 - Bick DP, McCorkle D, Stanley WS, Stern HJ, Staszak P,
Berkovitz GD et al. Prenatal Diagnosis of Smith-Lemli-Opitz
Syndrome in a pregnancy with Low Maternal Serum Oestriol
and a Sex-reversed fetus. Prenat Diagn 1999;19:68-71
18 - Abuelo DN, Tint GS, Kelley R, Batta AK, Shefer S, Salen G.
Prenatal Detection of the cholesterol Biosynthetic Defect in
the Smith-Lemli-Opitz syndrome by the Analysis of Amniotic
Fluid Sterols. Am J Med Genet 1995;56:281-5
19 - Dallaire L, Mitchell G, Giguère R, Lefebvre F, Melançon SB,
Lambert M. Prenatal diagnosis of Smith-Lemli-Opitz syndrome
is possible by measurement of 7-dehydrocholesterol
in amniotic fluid. Prenat Diagn 1995;15:855-8
20 - Linck LM, Hayflick SJ, Lin DS, Battaile KP, Ginat S,
Burlingame T, et al. Fetal demise with Smith-Lemli-Opitz
syndrome confirmed by tissue sterol analysis and the absence
of measurable 7-dehydrocholesterol Δ7-reductase
activity in chorionic villi. Prenat Diagn 2000;20:238-40
21 - Shackleton C, Roitman E, Kratz L, Kelley R. Dehydrooestriol
and dehydropregnanetriol are candidate analyse for
prenatal diagnosis of Smith-Lemli-Opitz syndrome. Prenat
Diagn 2001;21:207-12.
22 - Wassif CA, Maslen C, Kachilele-Linjewile S, Lin D, Linck
LM, Connor WE. Mutations in the human sterol Δ-7-reductase
gene at 11q12-13 cause Smith-Lemli-Opitz syndrome.
Am J Hum Genet 1998;63:55-62
23 - Waterham HR, Wijburg FA, Hennekam RC, Vreken P, Poll-
The BT, Dorland L, et al. Smith-Lemli-Opitz syndrome is
caused by mutations in the 7-dehydrocholesterol reductase
gene. Am J Hum Genet 1998;63:329-38
24 - Fitzky BU, Witsch-Baumgartner M, Erdel M, Lee JN, Paik
Y-K, Glossmann H et al. Mutations in the Δ-7-sterol reductase
gene in patients with the Smith-Lemli-Opitz syndrome.
Proc. Natl Acad Sci USA 95:8181-8186
25 - Witsch-Baumgartner M, Fitzky BU, Ogorelkova M, Kraft
HG, Moebius FF, Glossmann H et al. Mutational spectrum
in the delta 7-sterol reductase gene and genotype-phenotype
correlation in 84 patients with Smith-Lemli-Opitz syndrome.
Am J Hum Genet 2000;66:402-12
26 - Goldenberg A, Chevy F, Bernard C, Wolf C, Cormier-Daire
V. Circonstances cliniques du diagnostique du syndrome de
Smith-Lemli-Opitz et tentatives de corrélation phénotypegenótype:
à propos de 45 casirconstances cliniques du
diagnostique du syndrome de Smith-Lemli-Opitz et tentatives
de corr 84 patients with Smith-Lemli-Opit. Arch Pediatr
2003;10:4-10
27 - Bzdúch V, Kozák L, Franvová H, Behúlová D. Prenatal
Diagnosis of Smith-Lemli-Opitz syndrome by Mutation Analysis.
Am J Med Genet 2000;95:85
28 - Nowaczyk MJM, Farrell SA, Sirkin WL, Velsher L, Krakowiak
PA, Waye JS, Porter FD. Smith-Lemli-Opitz (RHS) Syndrome:
Holoprosencephaly and Homozygous IVS8-1G_C
Genotype Am J Med Genet 2001;103:75-80
29 - Nowaczyk MJM, Garcia DM, Eng B, Waye J. Rapid
Molecular Prenatal Diagnosis of Smith-Lemli-Opitz Syndrome.
Am J Med Genet 2001;102:287-388
30 - Löffler J, Utermann G, Witsch-Baumgartner M. Molecular
prenatal diagnosis of Smith-Lemli-Opitz syndrome is reliable
and efficient. Prenat Diagn 2002;22:827-30
31 - Löffler J, Trojovsky A, Casati B, Kroisel PM, Utermann G.
Homozygosity for the W151X Stop Mutation in the Δ7-sterol
Reductase Gene (DHCR7) Causing a Lethal Form of Smith-
Lemli-Opitz syndrome: Retrospective Molecular Diagnosis.
Sindrome de smith-maggenis
Síndrome de Smith-Magenis
A síndrome de Smith-Magenis é uma afecção genética pouco conhecida no Brasil que causa retardo mental e distúrbios de comportamento. Há uma variedade de sinais clínicos encontrados nos pacientes afetados, sendo alguns mais comuns em determinada faixa de idade. Para conhecermos um pouco mais sobre este assunto entrevistamos por e’mail o médico geneticista, Dr. Daniel Carvalho. Aqui ele nos responde questões gerais sobre a síndrome de Smith-Magenis, para você saber mais profundamente procure a ajuda de um serviço de Genética Clínica. O Serviço de Aconselhamento Genético(Unesp-Botucatu) está capacitado para fazer a avaliação dos pacientes e exames necessários, com isto vem realizando um esforço concentrado para a localização de casos no Estado de São Paulo, e desta forma, poder servir melhor os pacientes com esta afecção. Dr. Daniel Carvalho é médico com Residência Médica em Genética Médica pela USP de Ribeirão Preto e especialista em Genética Clínica pela Sociedade Brasileira de Genética Clínica. Pós-graduando do Departamento de Genética/Instituto de Biociências/UNESP-Botucatu.1 - O que é a síndrome de Smith-Magenis? Trata-se de uma afecção genética pouco diagnosticada que leva a retardo mental, distúrbio de comportamento e pode estar associada a diferentes anomalias congênitas. É uma doença de causa genética, mas não hereditária. Ou seja, não é transmitida de uma geração para outra.2 - O que causa a síndrome de Smith-Magenis? Sua causa se deve, em quase todos os casos, a uma perda de material genético (vários genes) da região cromossômica 17p11.2 que podemos detectar por exames genéticos específicos . Esta perda é um ‘acidente’ durante a formação de um dos gametas (células reprodutoras: óvulo ou espermatozóide) na transmissão do material genético. Em raros casos, a doença pode ser causada por mutação em um gene (RAI1) localizado nesta região e envolvido como o principal responsável pelos problemas da síndrome de Smith-Magenis.3 - Qual a incidência de casos da síndrome de Smith-Magenis no Brasil? Não existem estudos que apontem a incidência exata, mas pelo mecanismo da doença, estima-se que sua incidência no Brasil seja a mesma do resto do mundo: 01 criança afetada a cada 25.000 nascidos-vivos. No entanto, uma grande maioria dos casos não é diagnosticada no Brasil, mesmo nos grandes centros urbanos.4 - Quais os aspectos de um paciente com a síndrome de Smith-Magenis? Uma grande variedade de sinais clínicos pode ser encontrada nos pacientes afetados e também ocorrem sinais que são mais encontrados em determinadas faixas de idade. Algumas anomalias, principalmente oculares e do aparelho geniturinário, podem estar associadas. Até os 2 anos de idade os sinais dismórficos faciais (pequenas alterações no padrão da face que dão pistas para o diagnóstico) não são muito evidentes e as crianças apresentam atraso no desenvolvimento neuropsicomotor e são suspeitas de terem Síndrome de Down. São descritos como bebês dóceis e referido pouco choro e reatividade pelos pais. Dos 2 até 10 anos de idade alguns sinais são mais típicos: braquicefalia (cabeça achatada posteriormente); lábio superior proeminente e com aspecto em arco; fenda palpebral desviada para cima e distância dos olhos diminuída, face alargada e quadrada. Na adolescência os sinais faciais se tornam mais evidentes e também se percebe prognatismo (região do queixo para frente) e sobrancelhas espessas e que se juntam (sinofre). Contudo os problemas de comportamento e o atraso no desenvolvimento são os que se tornam mais significativos: retardo do desenvolvimento neuropsicomotor perceptível nos primeiros anos de vida; atraso significativo de linguagem; hiperatividade e déficit de atenção; várias formas de auto-injúria: bater a cabeça, morder-se, beliscar-se, puxar a pele; dificuldade para conseguir asseio corporal independente; acessos de birra (prolongada), raiva, agressão, mau humor, desobediência, teimosia. Muitas crianças afetadas pela Síndrome de Smith-Magenis estão sendo acompanhadas como deficiência mental sem causa definida ou como autistas.5 - Como pode ser feito o diagnóstico da Síndrome de Smith-Magenis? O diagnóstico pode ser confirmado através de um exame de sangue genético denominado FISH, que deve ser solicitado após a suspeita clínica por profissional que maneje crianças com atraso do desenvolvimento (médico geneticista ou neurologista infantil, por exemplo). Esta suspeita pode ser favorecida por alguns aspectos que são muito característicos nos pacientes com a Síndrome de Smith-Magenis: 1) Movimento estereotipado: abraçar-se ou apertar o tronco com os braços; 2) onicotilomania que é uma forma de auto-injúria onda a criança arranca frequentemente unhas das mãos e pés até sangrar; 3) poliembolocoilamania, também por sensibilidade periférica diminuída, que é a mania de inserir objetos em orifícios do corpo (conduto auditivo, narinas, ânus, vagina); 4) dificuldade para dormir: demora em conseguir pegar no sono, acorda e se agita várias vezes à noite não deixando os responsáveis repousarem.6- Qual tipo de acompanhamento necessário e o papel da família para o melhor desenvolvimento da criança? A criança precisa ser acompanhada por médico que possa identificar os problemas de saúde relacionados à doença, assim como profissional médico (psiquiatra, neurologista) que possa prescrever e acompanhar a medicação apropriada para atenuar os distúrbios de comportamento associados.Além disto, é fundamental o suporte de estimulação e de medidas comportamentais por uma equipe multiprofissional, principalmente de fonoterapia para aprimorar os recursos de linguagem expressiva.A família tem o papel essencial de trabalhar junto à equipe multiprofissional no manejo da dificuldade de comportamento e na aplicação das medidas comportamentais, além de contribuir para o trabalho de fonoterapia e dos cuidados médicos de rotina.
Doenças Metabólicas Hereditarias
Doenças Metabólicas Hereditárias
Dra. Mara Lúcia Ferreira
Médica Neuropediatra responsável pelos ambulatórios de bebê de risco e erros inatos do metabolismo da Unidade de Neurologia Infantil do Hospital Pequeno Príncipe (UNIPP)
As doenças metabólicas hereditárias são causadas por erro inato do metabolismo. No inicio do século XX, em 1908, publicado no Lancet, Archibold Garrod, usou o termo erro inato do metabolismo, para se referir a algumas situações clínicas. A primeira doença estudada foi a Alcaptonúria (aumento da excreção do ácido homogentísico), que leva a artrite, e a urina fica escura após algumas horas em contato com o ar. Posteriormente descreveu o albinismo, cistinúria e a pentosúria, que também deveria ser erro inato do metabolismo (EIM).
O termo EIM se aplica a um grupo de doenças geneticamente determinadas, decorrente da deficiência em alguma via metabólica que está envolvida na síntese (anabolismo), transporte ou na degradação (catabolismo) de uma substância.
De 1908 para cá tivemos avanços no número de erros inatos conhecidos, que hoje ultrapassam 400, e são estudados por um ramo da medicina, que se chama Bioquímica Genética.
A incidência das doenças do EIM são individualmente raras, sua incidência cumulativa é de 1:5000 aos recém-nascidos vivos. Em triagem neonatal de um maior número de EIM utilizando-se a espectrometria de massa, observa-se incidência de 1:3803.
No Brasil temos incidência de algumas patologias isoladas como a fenilcetonúria = 1:11818 a 1:15000, leucinose = 1:43000 e deficiência de biotinidase = 1:125000.
Apesar da evolução das técnicas bioquímicas e genéticas, a incidência das doenças do EIM não tem aumentado, provavelmente porque o diagnóstico está sendo subestimado, devido a alguns fatores: como são consideradas raras, leva muitos médicos a uma pesquisa mais tardia, além disso, as amostras de urina e sangue devem ser pesquisados no momento da doença aguda, e por último muitas doenças produzem somente anormalidades intermitentes.
Classificação Clinica:
Categoria 1 = doenças que envolvem somente um sistema, ou afetam somente um órgão ou sistema anatômico; os sintomas são uniformes.
Categoria 2 = a lesão bioquímica básica afeta uma via metabólica comum, e um grande número de células ou órgãos; apresenta diversidade de sintomas.
Divide-se em 3 grupos:
Grupo 1 - Defeito da síntese ou catabolismo de moléculas complexas.
Grupo 2 - Defeito do metabolismo intermediário.
Grupo 3 - Defeito na produção ou utilização de energia.
Grupo 1 (defeito da síntese ou catabolismo de moléculas complexas):
Características: sinais e sintomas permanentes e progressivos.
Doenças: lisossomiais e perixissomais.
Grupo 2 (defeito do metabolismo intermediário):
Características: intoxicação aguda e crônica. Intervalo livre de sintomas, relação com ingesta alimentar.
Doenças: aminoacidopatias, Acidúrias Orgânicas, Defeitos do ciclo da uréia e intolerância aos açucares.
Grupo 3 (defeito na produção ou utilização de energia):
Características: metabolismo intermediário do fígado, músculo ou cérebro.
Doenças: depósito de glicogênio, defeitos de B-oxidação de ácidos graxos; doenças mitocondriais e hiperlactacidemias congênitas.
Sintomas Agudos no período Neonatal: “Distúrbios Metabólicos Neonatais”
Identificação da criança de risco:
1- Sinais clínicos inespecíficos:
alteração do estado geral
transtorno neurológico (hipotonia, sonolência, hiporeatividade,...)
transtornos digestivos (recusa alimentar, vômitos, dor abdominal,...)
transtornos respiratórios (taquipnéia, bradipnéia,...).
2- Sinais e elementos invocadores:
antecedentes familiares de morte neonatal inexplicáveis, consangüinidade, abortos de repetição.
intervalo neonatal livre de sintomas.
deterioração progressiva sem causa aparente e que não respondam a terapia sintomática.
3- Sinais clínicos específicos:
deterioração neurológica rápida e progressiva (alteração de consciência, tônus, movimentos anormais, alteração especial EEG).
odor especial na urina.
miopatias, cardiomiopatias.
dismorfia crânio facial.
4- Apresentação essencial como doença hepática:
hepatomegalia.
icterícia.
vômitos.
letargia.
alteração da função hepática.
*A presença de uma infecção não descarta a coexistência de um EIM, já que o EIM desencadeia a sintomatologia.
SINAIS CLÍNICOS E ETIOLOGIA DAS DOENÇAS METABÓLICAS:
TIPO I:
Distúrbio Neurológico tipo intoxicação com cetose: Doença mais freqüente: MSUD (leucinose).
TIPO II:
Distúrbio Neurológico tipo intoxicação com desidratação: Doenças mais freqüentes: MMA (acidemia metilmalônica), PA (acidemia propiônica), IVA (acidemia isovalérica), MCD (deficiência múltipla de carboxilase).
Distúrbio Neurológico tipo deficiência energética com sinais hepáticos: Doenças mais freqüentes: GA II (acidúrias glutárica), CPT II (carnitina palmital transferase II), LCAD (deficiência de acilcoenzima A desidrogenasse de cadeia longa), HMG-coaliase (coenzima A 3 metil glutaril 3 hidroxi).
TIPO III:
Distúrbio Neurológico tipo deficiência energética com taquipnéia e hipotonia: Doenças mais freqüentes: Acidose Láctica Congênita (PC, PDH, Ciclo Krebs, Cadeia Respiratória), MCD (deficiência múltipla de carboxilase).
TIPO IV a:
Distúrbio neurológico tipo intoxicação com sinais hepáticos: Doenças mais freqüentes: Doenças do Ciclo da Uréia, HHH (homocitrulinúria, hiperamonemia e hiperornitinemia), Defeitos da oxidação de ácidos graxos (GA II, CPT II, LCAD, LCHAD).
TIPO IV b:
Distúrbio Neurológico tipo convulsões e mioclonias: Doenças mais freqüentes: NKH (hiperglicinemia não cetótica), SO-XO (sulfite oxidase e xantine oxidase).
TIPO IV c:
Doenças de acúmulo, fácies grosseira, hepatoesplenomegalia, ascite, hidropisia neonatal, macroglossia, mancha vermelha cereja, linfócitos vacuolados: Doenças mais freqüentes: GMI (gangliosidose), ISSD (sialidose tipo I), Doença de Gauche, Niemann-Pick tipo C, Mucopolissacaridose tipo VII, Galactosialidose, Sialúria.
TIPO V:
Hepatomegalia e Hipoglicemia: Doenças mais freqüentes: Glicogenose tipo I e III, Deficiência difosfatase frutose.
Hepatomegalia, Icterícia e Insuficiência Hepática: Doenças mais freqüentes: Intolerância hereditária a frutose, Galactosemia, Tirosenemia tipo I, Hemocromatose neonatal, Doença de Wilson, Alfa-1- antitripsina, Doença de cadeia respiratória.
EXAMES SOLICITADOS QUANDO SUSPEITA DE EIM:
Sangue:
Hemograma
Gasometria
Na
K
Cl
“Anion Gap” - (Na) – (HCO3 + Cl)
Glicemia
Lactato
Amônia
TGO, TGP, gama-GT.
Uréia, Creatinina.
Ácido Úrico
Colesterol, Triglicerídios.
Urina:
Parcial (pH, densidade, corpos cetônicos)
Triagem para EIM (DNPH, Nitroprussiato de prata, Benedict, Cloreto férrico, Azul de toluidina, Reação de CTMA e Nitrosonaftol).
Cromatografia de aminoácidos, açúcares e ácidos orgânicos.
CASUÍSTICA DE ERROS INATOS DO METABOLISMO NO PERÍODO NEONATAL DO HOSPITAL INFANTIL PEQUENO PRÍNCIPE NO PERÍODO DE 1994 – 2001.
Número de casos: 29 casos
Sexo:
Feminino: 17 casos
Masculino: 12 casos
Idade Média de início dos sintomas: 30 dias
Patologias mais encontradas:
Acidúrias Orgânicas: Acidúrias Metilmalônica – 2 casos
Acidúrias Isovalérica – 1 caso
Acidúrias Glicérica – 1 caso
Aminoacidopatias: Fenilcetonúria –1 caso
MSUD –1 caso
Homocistinúria – 1 caso
Tirosenemia –1 caso
Hiperglicinemia não cetótica – 1 caso
Doenças Lisossomiais: Gangliosidose – GM1 –3 casos
Mucopolissacaridose tipo I – Hurler –1 caso
Doença de Tay-Sacks – 1 caso
Defeito na Oxidação de Ácidos Graxos: MCAD –1 caso
LCAD –1 caso
Acidemia Glutárica tipo II –2 casos
Intolerância aos Açúcares: Galactosemia –2 casos
Mucolipidose: Glicogenose-tipo II (Doença de Pompe) – 3 casos
Deficiência de Biotinidase – 3 casos
Reye-like – 3 casos
Referências Bibliográficas:
!. Scriver, C. R., Beaudet, L., Sly, W.S. and Valle, D. The Metabolic and Molecular Bases of Inherited Disease, 1995.
2. Lyon , G., Adams , R.D., and Kolodny, E. H., Neurology of Hereditary Metabolic Diseases of Children, 1996.
3. Martins, AM; Dalmeida, V; Micheletti, C; Santos, LMG; Aoki, MM e Macedo, DM - Erros Inatos do Metabolismo: avaliação de um protocolo de investigação clínica e laboratorial. Rev. Saúde Pública, 2000.
4. Instituto Fleury-Erros Inatos do Metabolismo-Perguntas e Respostas -On-line Copyright © 2005- Word Wide Web URL: www.Institutofleury.org.br.
terça-feira, 25 de agosto de 2009
PSEUDOXANTOMA ELASTICO
Pseudoxantoma elástico
definição
Doença generalizada do tecido conectivo envolvendo a pele, olhos e sistema cardiovascular e resultando de fragmentação e calcificação das fibras elásticas. Geralmente se apresenta após a puberdade, as manifestação características são manchas pequenas, circunscritas, amareladas, localizadas no pescoço, axila e pregas inguinais. Linhas angióides na retina, tendência a hemorragia e insuficiência arterial são as complicações mais comuns. Esta doença pode ser herdada como autossômica dominante ou recessiva.
ALBINISMO OCULO CUTÂNEO
Albinismo oculo-cutâneo
O albinismo óculo-cutâneo associado à deficiência auditiva apresenta herança autossômica recessiva. Isoladamente apresenta heterogeneidade não-alélica e formas clínicas distintas. É caracterizado por diminuição da pigmentação de pele e/ou pêlos e/ou olhos. É classificado nos seguintes tipos:
- tipo I (ou albinismo óculo-cutâneo tirosinase-negativa) 8 (OMIM*203100): Resulta de mutações no gene da tirosinase que levam a perda da função da enzima tirosinase sobre o melanócito. Variam desde ausência total de pigmento até a pigmentação próxima do normal, uma importante característica é a presença de hipopigmentação marcante ao nascimento. Apresenta os subtipos 1A e 1B, ambos mapeados para o lócus 11q14-q21.
- tipo II (ou albinismo óculo-cutâneo tirosinase-positiva) 8 (OMIM*203200): É o tipo mais prevalente de albinismo óculo-cutâneo. É caracterizado pela presença de certa pigmentação ao nascimento e que se reduz com o tempo. Foi mapeado para o lócus 15q11.2-q12.
- tipo III (ou albinismo marrom) 8 (OMIM#203290): Mapeado para o lócus 9p23, caracteriza-se por cabelo de cor castanho claro e íris de cor variando de cinza a castanho ao nascimento. Com o passar do tempo, ocorre apenas discreta alteração na cor da pele, porém, o cabelo e a íris tornam-se mais escuros.
Além destes, diversos quadros de síndromes com graus variáveis de hipopigmentação são descritos na literatura.
Os achados oculares frequentemente encontrados nos vários tipos de albinismo óculo-cutâneo podem ser: diminuição da pigmentação da íris e retina, nistagmo, fotofobia, erros refracionais e diminuição da acuidade visual.
SINDROME DE GOLDENHAR
Síndrome de Goldenhar
Na Síndrome de Goldenhar 8 (Espectro oculoauriculovertebral) (OMIM164210) muitos casos são esporádicos, algumas famílias apresentaram herança autossômica recessiva, outras apresentaram herança claramente autossômica dominante. É uma entidade geneticamente heterogênea. Os defeitos encontrados nesta síndrome são devidos a problemas na morfogênese dos primeiro e segundo arcos branquiais, associados a anomalias vertebrais e/ou oculares.
As características clínicas desta síndrome são: deformidade da orelha externa até anotia, apêndices pré-auriculares geralmente anteriores ao tragus, implantação baixa das orelhas, lipodermóide da conjuntiva ou córnea, coloboma em pálpebra superior, microftalmia ou anoftalmia, anomalias de orelha média levando a perda auditiva de natureza condutiva e anomalias vertebrais.
Nos três pacientes examinados foram encontrados todas as alterações oculares.
Outras malformações oculares isoladas também foram encontradas, como por exemplo: atrofia de papila, malformação de papila, anomalia de pálpebra, hamartoma de retina, leucoma, miopia, glaucoma, albinismo oculo-cutâneo, obstrução das vias lacrimais, phithisis bulbi e estrabismo. Entretanto, não foi possível juntar estes diagnósticos em um diagnóstico sindrômico ou etiológico estabelecido.
SINDROME DE STICKLER
Síndrome de Stickler
A Síndrome de Stickler 8 (Artro-oftalmopatia hereditária) (OMIM#108300 e #184840), inicialmente descrita em 1965, é de herança autossômica dominante, trata-se de uma desordem do tecido conjuntivo. A sua prevalência é estimada em 1:10000 pessoas 7.
A Síndrome de Stickler é classificada em três tipos, de acordo com o gene no qual ocorre a mutação: tipo I por mutação no gene do COL2A1 (OMIM#108300), tipo II por mutação no gene do COL11A2 (OMIM#184840) e tipo III por mutação no gene do COL11A1 (OMIM#121028). Existem evidências que sugerem a existência de um quarto tipo desta síndrome.
As manifestações clínicas encontradas nesta síndrome são anormalidades oculares e orofaciais, artropatia e deficiência auditiva. As manifestações oculares, descritas podem ser: miopia de moderada a severa com início na primeira década da vida, descolamento de retina, degeneração vitreorretiniana, catarata e glaucoma. As alterações orofaciais descritas são: achatamento da região média da face, complexo de Pierre Robin (micrognatia, glossoptose e anormalidade da mobilidade do palato). Podem ser encontradas também estatura baixa ou fenótipo marfanóide com hiperextensibilidade articular e artrite precoce. Aproximadamente 50% dos pacientes podem apresentar prolapso de valva mitral. A surdez é geralmente neurossensorial, podendo ter também um componente condutivo.
Nos 2 pacientes examinados formam encontrados todas as alterações oculares. Um deles apresentou além do quadro referido, palidez de papila.
DOENÇA DE NORRIE
Doença de Norrie
A Doença de Norrie 8 (OMIM*310600) apresenta herança ligada ao X recessiva e foi mapeada para o locus Xp11.4.
As manifestações clínicas descritas nesta doença são: perda auditiva neurossensorial progressiva, retardo mental e alterações oculares. As manifestações oculares descritas são: pseudotumor de retina bilateral e congênito, hiperplasia de retina, displasia retiniana em geral grave, hipoplasia e necrose das camadas mais internas da retina, catarata, phthisis bulbi e pode ter descolamento de retina.
A Doença de Norrie é frequentemente de difícil diagnóstico porque mais da metade dos pacientes não apresenta nem perda auditiva e nem retardo mental, consideradas, junto aos sintomas oculares específicos, características clássicas.
Nos 2 pacientes examinados foram encontradas a displasia retiniana severa.
SINDROME DE WAARDENBURG
Síndrome de Waardenburg
A Síndrome de Waardenburg 8 (OMIM*193500) apresenta herança autossômica dominante com penetrância incompleta e expressividade variável 6. Existem evidências de que a idade paterna influencia na ocorrência de mutações novas.
Existem quatro subtipos moleculares desta síndrome, que são baseados em uma heterogeneidade genética:
- tipo I (OMIM*193500): Todos os subtipos do tipo I apresentam mutação do gene PAX3 no cromossomo 2q35;
- tipo II (OMIM#193510): Mutação no gene MITF. Apresenta dois subtipos:
IIA - Mutação em um gene no cromossomo 3p12.3-14.1;IIB - Mutação em um gene no cromossomo 1p21-p13.3;
- tipo III (OMIM#148820): Trata-se também de uma mutação no gene PAX3, podendo ser considerado uma variação de expressão extrema do tipo I, ou de uma síndrome do gene contíguo devido à deleção do gene PAX3 e de genes adjacentes.
- tipo IV (OMIM#277580): Mutação em 22q13 (gene SOX10), 20q13.2-q13.3 (geneEDN3)e 13q22 (gene EDNRB).
Em todos os quatro tipos ocorre perda auditiva neurossensorial. A surdez é secundária à disgenesia coclear, uni ou bilateral e de diferentes graus de acometimento. As outras manifestações clínicas dos subtipos desta síndrome são: deslocamento lateral do canto medial e do ponto lacrimal inferior (distopia, encontrado no tipo I), base do nariz alargada, heterocromia total ou parcial da íris, fundo de olho albinóide, hiperplasia da porção medial dos supercílios frequentemente com sinofris superciliar, mecha branca frontal no cabelo ou canície precoce, associação com fendas palatinas e labiais, nariz com abas pequenas, narinas fechadas e extremidade arredondada e assimetria facial.
Na heterocromia da íris, a íris hipopigmentada apresenta uma coloração azul clara, pálida por hipoplasia do estroma, que é visível à biomicroscopia.
Os 5 pacientes com Síndrome de Waardenburg examinados neste trabalho apresentavam todas as características oculares. Exceto um paciente que não apresentava fundo de olho totalmente albino, era apenas hipopigmentado em algumas áreas da retina.
SINDROME DE TREACHER -COLLINS
Síndrome de Treacher-Collins
A Síndrome de Treacher-Collins 8 (Disostose mandibulofacial) (OMIM*154500) apresenta herança autossômica dominante e é uma entidade clinicamente heterogênea. O lócus desta doença foi mapeado em 5q32-33.1 e existem evidências de que a idade paterna influencia na ocorrência de mutações novas.
As manifestações clínicas dessa doença são: fenda palpebral antimongolóide, coloboma de pálpebra inferior, micrognatia, microtia, deformidade da orelha, hipoplasia dos arcos zigomáticos e macrostomia. O diagnóstico diferencial se faz com a Síndrome de Nager (disostose acrofacial) e com a Síndrome de Goldenhar (espectro oculoauriculovertebral).
Nos dois pacientes examinados foram encontrados todas as características oculares
SINDROME DE USHER
Síndrome de Usher
A Síndrome de Usher 8 (OMIM *276900) é uma condição genética com heterogeneidade não alélica e formas clínicas distintas.
Na Síndrome de Usher a perda auditiva neurossensorial hereditária em graus variados está associada a retinose pigmentária (RP). A RP é uma degeneração hereditária e progressiva da retina. Fotorreceptores, células ciliadas auditivas e células ciliadas vestibulares se desenvolvem a partir de células ciliadas progenitoras. Inúmeras evidências sugerem que uma anormalidade generalizada de estruturas do axonema está presente em pacientes com Síndrome de Usher.
A síndrome é classificada nos seguintes tipos:
- tipo I: Condição autossômica recessiva com heterogeneidade genética. Caracterizada por surdez congênita severa, instalação precoce de RP e ausência de funções vestibulares. Apresenta os seguintes subtipos, classificados de acordo com o locus gênico:
1A(OMIM*276900) - 14q 32;1B(OMIM*276903) - 11q;1C(OMIM*276904) - 11p15.1;1D(OMIM*601067) - 10q;1E(OMIM*602097) - 21q21;1F(OMIM*602083) - Chr.10.
- tipo II: Condição autossômica recessiva com heterogeneidade genética. Caracterizada por surdez congênita moderada a severa, instalação tardia de RP e funções vestibulares normais. Apresenta dois subtipos:
2A(OMIM*276901) - 1q32-q41;2B(OMIM*276905) - o lócus ainda não foi definido -tipo III (OMIM*276902): Condição autossômica recessiva, lócus mapeado em 3q21-q25. Caracterizada por visão e audição inicialmente normais ou próximas do normal que pioram progressivamente ao longo de décadas.
- tipo IV: forma ligada ao X.
Outras manifestações clínicas associadas podem ser: perda visual progressiva "tipo retinose pigmentária", catarata, anormalidades vestibulares, retardo mental, ataxia e psicose.
Nos 5 pacientes examinados foi encontrada a retinose pigmentária.
SINDROME DE NOONAN
Nomes alternativos:
síndrome semelhante à síndrome de Turner
Definição:
Grupo de anormalidades específicas que afeta igualmente homens e mulheres (de maneira esporádica), mas que reflete a um componente hereditário (acredita-se que seja autossômico dominante).
Causas, incidência e fatores de risco:
Em algumas famílias, a síndrome Noonan pode apresentar um padrão de transmissão de homens para homens. Os sintomas variam. As anormalidades vistas com freqüência incluem enrugamento do pescoço, alterações no esterno (em geral um tórax afundado, chamado de peito escavado), anormalidades faciais e doenças cardíacas congênitas (geralmente estenose pulmonar).
As anormalidades faciais podem incluir orelhas de implantação baixa ou de formato anormal, pálpebras caídas (ptose), olhos muito separados (hipertelorismo), pregas epicânticas e mandíbula pequena (micrognatia). Pode também ocorrer retardo mental leve. A perda da audição é variável. A puberdade geralmente é retardada e os homens podem ter testículos retidos e pênis pequeno. Os adultos geralmente apresentam baixa estatura.
DOENÇA MILROY -MEIGE- NONNE
A doença de Milroy-Meige-Nonne é uma forma primária de edema linfático, geralmente localizada nos membros inferiores e bilateral. A moléstia é causada pela drenagem linfática inadequada, devido ao desenvolvimento anormal dos vasos linfáticos. Trata-se de condição hereditária com transmissão autossômica dominante. O caso apresentado é de linfedema congênito localizado no membro inferior esquerdo. Seis outros familiares da paciente em estudo também apresentaram linfedema congênito.Palavras-chave: DOENÇA DE MILROY , LINFEDEMA ,
INTRODUÇÃO
A doença de Milroy-Meige-Nonne (DMMN) ou linfedema congênito hereditário é uma forma primária de edema linfático, geralmente restrita aos membros inferiores.1 Esta terminologia deve ser reservada para os casos de linfedema congênito onde há clara evidência de herança autossômica dominante,2,3,4 com penetrância variável.5
Os vasos linfáticos originam-se de células mesenquimais pluripotenciais ou de vasos venosos modificados. A rede linfática acompanha os principais troncos vasculares, desembocando no sistema venoso, através do ducto torácico, próximo ao coração. Apresentam valvas que auxiliam a mobilização da linfa. A contração da musculatura esquelética é, no entanto, a maior responsável por esta mobilização. Os membros inferiores apresentam dois plexos linfáticos, um mais superficial e outro mais calibroso e profundo.2 O endotélio linfático é mais permeável do que dos vasos sangüíneos, permitindo a livre passagem das proteínas plasmáticas.5,6 A linfa se caracteriza por ser um líquido viscoso, de coloração amarelada, riquíssimo em proteínas reabsorvidas do compartimento extracelular.
O linfedema é formado pelo acúmulo anormal de linfa nos tecidos moles. Pode ser classificado em primário, quando ocorre de forma idiopática, ou secundário a processos obstrutivos e inflamatórios (Tabela 1).4,7
Apresenta-se um caso de DMMN, acometendo diversas pessoas de uma mesma família, configurando um padrão autossômico dominante de herança.
RELATO DE CASO
S.M., 14 anos, fem., br., estudante, nat. e residente no Rio de Janeiro, RJ.
Apresenta, desde o nascimento, edema bilateral, frio, duro, indolor e simétrico dos pés. Há três meses evoluiu com linfedema, acometendo toda a perna esquerda, acompanhado de máculas hipocrômicas lenticulares situadas na face anterior da perna esquerda (Figura 1).
O exame físico geral revelou paciente lúcida e orientada, hidratada, normocorada, anictérica e acianótica. Apresentava-se apirética e com pulsos homólogos e ritmados.
O heredograma, apresentado na figura 2, demonstrou a existência de edema linfático localizado nos membros inferiores da avó materna, mãe e um primo em primeiro grau (perna direita), um tio materno (perna esquerda), uma tia e um tio maternos (linfedema bilateral).
DISCUSSÃO
A DMMN é uma forma primária de edema linfático, geralmente restrita aos membros inferiores. A desordem é causada pelo desenvolvimento incompleto do sistema de drenagem linfático.3 Ocorre hipoplasia dos troncos linfáticos mais calibrosos, responsáveis pelo surgimento perinatal do edema linfático.5 A herança autossômica dominante está sempre presente, afetando igualmente ambos os sexos.3,5 Mutações genéticas espontâneas explicam os raros casos da DMMN com história familial negativa.8,9 A paciente estudada apresentou edema congênito bipodal, com posterior acometimento de toda a perna esquerda, na adolescência. O heredograma demonstrou extenso acometimento familial, embora não haja evidência de consangüinidade.
Os linfedemas primários incluem, além da DMMN, a forma precoce e a tardia (Tabela 1).4,7 No primeiro caso, o edema começa antes dos 35 anos e pode associar-se com outras anomalias congênitas, como polidactilia, sindactilia, anomalias vertebrais, colestases e malformações vasculares cerebrais.5 A forma tardia é mais rara, iniciando-se após a terceira década de vida, e associando-se ao quilotórax.3,6,8
As formas secundárias de linfedema são de etiologia obstrutiva ou inflamatória. Proliferações neoplásicas podem provocar compressões dos vasos linfáticos. Ressecções cirúrgicas e radioterapia são importantes causas de lesão do sistema linfático, como nos linfedemas pós-mastectomia.2 Alguns processos granulomatosos crônicos, como sarcoidose, também produzem edema linfático do tipo obstrutivo.
O linfedema inflamatório caracteriza-se pela história de linfangite e celulite recorrente, com trombose dos vasos linfáticos e fibrose dérmica.4 A infecção estreptocócica é a causa mais comum de linfedema infeccioso, gerando quadro de inflamação crônica, fibrose e hipertrofia do tecido conectivo dérmico e subcutâneo, conhecido como elefantíase nostra. A filariose linfática, produzida pelo nematódeo Wuchereria bancrofti, é muito prevalente em diversos Estados das regiões Norte e Nordeste do Brasil.
O diagnóstico diferencial entre os linfedemas primários e secundários é feito, fundamentalmente, pela história clínica. No primeiro grupo, o edema linfático inicia-se nas quatro primeiras décadas de vida, com ligeira predominância no sexo masculino e história de linfangite ou celulite em cerca de 20% dos casos.4 Os linfedemas secundários são mais tardios, predominando após a quinta década de vida, e acompanhados por um cortejo clínico que permite o diagnóstico etiológico subjacente.
Métodos radiológicos contrastados, como a venografia e a linfangiografia, raramente são utilizados no esclarecimento diagnóstico da DMMN.4,10 Tais métodos podem servir como via de infecção para diversos microorganismos, como germes piogênicos11 e o Criptococcus neoformans.12
Brostrom et al.13 destacam que a degeneração sarcomatosa é raramente observada na DMMN. Lesões maculosas, como as observadas na região pré-tibial da paciente estudada (Figura 1), podem estar associadas à manifestações neoplásicas agressivas da extremidade linfedematosa.13,14 Stewart e Treves15 descreveram, em 1948, o clássico desenvolvimento de linfangiossarcoma em pacientes mastectomizadas, cursando com grande linfedema do membro superior. Não foram detectadas, no entanto, degenerações neoplásicas nos portadores da DMMN estudados.
O controle clínico do edema linfático pode ser parcialmente obtido por medidas, como a elevação dos membros inferiores, uso de bandagens elásticas compressivas, terapêutica diurética intermitente e profilaxia antibiotico-terápica.4,5 O tratamento cirúrgico pode ser indicado em casos avançados de linfedema, visando a melhorar a drenagem linfática ou retirar o excesso de pele e tecido celular subcutâneo.4,16 No caso em estudo, optou-se pelo acompanhamento clínico e o uso de bandagens compressivas de forma contínua. -->
Referências
Milroy WF. Chronic hereditary edema: Milroy's disease. JAMA 1928;91:1172-74.
Allen EV. Lymphedema of the extremities: etiology, classification and differential diagnosis; a study of three hundred cases. Arch Intern Med 1934;54:606-24.
Mihaescu T, Veres L, Zbranca V. Chylothorax in familial lymphedema of the Meige type. Chest 1992;101:290-91.
Gloviczi P, Schirger A. Lymphedema. In: Spittell JA. Clinical medicine. Philadelphia: Harper & Row, 1986. v.6.
Kubryk N, Roger M. La maladie de Meige-Milroy et Nonne: a propos d'une observation chez un enfant de six mois. Ann Pediatr (Paris) 1990;37(7):481-82.
Stalder JF, Berger M. Lymphoedème de Milroy-Meige-Nonne et lymphoedème congénital non familial: méthodes d'exploration, problèmes thérapeutiques. Ann Dermatol Venereol 1980;107:665-67.
Smetzer DM, Stickler GB, Schirger A. Primary linphedema in children and adolescents: a follow-up study and review. Pediatrics 1985;76:206-18.
Bollinger A, Isenring G, Franzeck UK et al. Aplasia of superficial lymphatic capillaries in hereditary and connatal lymphedemas (Milroy's disease). Lymphology 1983;16:27-30.
Har-el G, Borderon ML, Weiss MH. Choanal atresia and lymphedema. Ann Otol Rhinol Laryngol 1991;100:661-64.
Jackson FI, Bowen P, Lentle BC. Scintilymphangiography with 99 m Tc-antimony sulfide colloid in hereditary lymphedema (Nonne-Milroy disease). Clin Nucl Med 1978;3:296-98.
Albornoz MA, Myers AR. Recurrent septic arthritis and Milroy's disease. J Rheumatol 1988;15:1726-28.
Krywonis N, Kaye VN, Lynch PJ. Cryptococcal cellulitis in congenital lymphedema. Int J Dermatol 1990;29:41-4.
Brostrom LA, Nilsonne U, Kronberg M et al. Lymphangiosarcoma in chronic hereditary oedema (Milroy's disease). Ann Chir Gynaecol 1989;78:320-23.
Wendt T, Kietzmann H, Schubert C et al. Progressive keratotic lymphangioma and angiosarcoma (Stewart-Treves syndrome) in a patient with congenital lymphedema. Hautarzt 1988;39:155-60.
Stewart FW, Treves N. Lymphangiosarcoma in post-¬mastectomy lymphedema: report of six cases in elephantiasis chirurgica. Cancer 1948;1:64-81.
Ipsen T, Pless J, Frederiksen PB. Experience with microlymphaticovenous anastomoses for congenital and adcquired lymphedema. Scand J Plast Reconstr Surg 1988;22:233-36.
SÍNDROMES MIOTÔNICAS
SÍNDROMES MIOTÔNICAS
São fenômenos próprios da fibra muscular, cuja característica principal é a dificuldade de relaxamento dos músculos esqueléticos após contração muscular, percussão, estimulação elétrica entre outros fenômenos.
A fraqueza muscular é um problema comum, mas, freqüentemente, tem significados diferentes para indivíduos diferentes. Para alguns, ela significa simplesmente cansaço ou esgotamento. No entanto, na fraqueza muscular verdadeira, um grande esforço não gera uma força normal. A fraqueza pode afetar todo o corpo ou ser limitada a um membro superior, a um membro inferior ou mesmo a uma mão ou um dedo. Embora a fraqueza possa ser decorrente de problemas musculares, tendinosos, ósseos ou articulares, ela é mais freqüentemente causada por problemas do sistema nervoso. Alguns casos de fraqueza sempre ocorrem após uma doença e, freqüentemente, ocorre em indivíduos idosos (sarcopenia).
Diagnóstico
Ao avaliar um indivíduo com fraqueza muscular, o médico busca indícios para identificar a causa do problema, tenta estabelecer exatamente quais músculos estão fracos e quantificar o grau dessa fraqueza. Os músculos são examinados de forma sistemática, começando geralmente pela face e o pescoço, continuando pelos membros superiores e, finalmente, os membros inferiores. Normalmente, o indivíduo deve ser capaz de manter os membros superiores estendidos durante alguns minutos sem que eles balancem ou tremam. A incapacidade de manter os braços nessa posição pode ser um sinal de fraqueza.
A força de grupos musculares contra resistência é avaliada através de ações de empurrar ou puxar enquanto o médico faz o mesmo na direção oposta. As provas funcionais podem fornecer informações sobre a fraqueza muscular. Para isso, o indivíduo deve realizar várias manobras enquanto o médico observa qualquer deficiência existente nos grupos musculares envolvidos.
Por exemplo, pode ser comprovada a capacidade do indivíduo de levantar-se de uma cadeira sem ajuda dos braços, de agachar-se e levantar-se da posição agachada, de manter-se sobre as pontas dos dedos dos pés ou dos calcanhares e de segurar um objeto com a mão. O médico procura indícios de perda de massa muscular (atrofia), a qual pode ser resultante da lesão do próprio músculo ou dos seus nervos.
Causas de Fraqueza Muscular
Problema Subjacente
Exemplo
Principais Conseqüências
Lesão cerebral
Acidente vascular cerebral ou tumor cerebral
Fraqueza ou paralisia do lado do corpo oposto à lesão cerebral. A articulação da linguagem, a deglutição, a personalidade e os processos do pensamento podem ser afetados
Lesão da medula espinhal
Traumatismo do pescoço ou das costas, tumores da medula espinhal, estreitamento (estenose) do canal espinhal, esclerose múltipla, mielite transversa, deficiência de vitamina B12
Fraqueza ou paralisia dos membros superiores e inferiores abaixo do nível da lesão, perda progressiva da sensibilidade abaixo do nível da lesão, dor nas costas. As funções intestinais, da bexiga e sexuais podem ser afetadas
Degeneração de nervos da medula espinhal
Esclerose lateral amiotrófica
Perda progressiva da massa e da força muscular, mas sem perda da sensibilidade
Lesão de raízes nervosas espinhais
Ruptura de disco intervertebral no pescoço ou na parte inferior da coluna vertebral
Dor no pescoço e fraqueza ou adormecimento de um membro superior, dor lombar com irradiação para um membro inferior (ciática) e fraqueza ou adormecimento do membro inferior
Lesão de um único nervo (mononeuropatia)
Neuropatia diabética, compressão local
Fraqueza ou paralisia dos músculos e perda da sensibilidade da área inervada pelo nervo lesado
Lesão de vários nervos (polineuropatia)
Diabetes, síndrome de Guillain- Barré, deficiência de folato, outras doenças metabólicas
Fraqueza ou paralisia dos músculos e perda da sensibilidade das áreas inervadas pelos nervos afetados
Doença da junção neuromuscular
Miastenia grave, intoxicação por curare, síndrome de Eaton-Lambert, envenenamento por inseticida
Paralisia ou fraqueza de muitos músculos
Doença muscular
Doença de Duchenne (distrofia muscular) Infecções ou distúrbios inflamatórios (miosite viral aguda, polimiosite)
Fraqueza muscular progressiva generalizada Músculos sensíveis ou dolorosos e fracos
Problemas psicológicos
Depressão, sintomas imaginários, histeria (reação de conversão), fibromialgia
Queixa de fraqueza generalizada, paralisia sem evidência de lesão nervosa
A atrofia muscular também pode ser causada por falta de uso (atrofia por desuso), como algumas vezes ocorre em decorrência do confinamento ao leito prolongado. O aumento da musculatura (hipertrofia) geralmente ocorre com exercícios como o levantamento de peso. Quando o indivíduo apresenta uma doença, a hipertrofia é decorrente de um músculo que trabalha mais para compensar a fraqueza de um outro. Os músculos também podem aumentar de volume quando o tecido muscular normal é substituído por tecido anormal, como ocorre na amiloidose e em determinados distúrbios musculares hereditários (p.ex., miotonia congênita).
Durante o exame físico, o médico, ao palpar os músculos, observa a sensibilidade e a textura. Normalmente, um músculo é firme, mas não é duro, e liso, sem protuberâncias. Também pode ser verificada a presença de movimentos anormais. Os espasmos musculares breves, finos e irregulares visíveis sob a pele (fasciculações) geralmente indicam uma doença dos nervos, embora, às vezes, eles também ocorram em indivíduos saudáveis (especialmente quando o indivíduo está nervoso ou ou sente frio) e, comumente, ocorrem nos músculos da panturrilha de indivíduos idosos.
Chegando à Raiz da Fraqueza Muscular
Problema nos Nervos
Problema nos Músculos
Os músculos podem atrofiar, mas podem ser mais fortes do que parecem
Os músculos podem estar mais fracos do que parecem
Ocorrência de pequenos espasmos musculares sob a pele
Ausência de pequenos espasmos musculares sob a pele
Os reflexos tornam-se inesperadamente diminuídos ou estão totalmente ausentes
Os reflexos podem estar presentes, apesar dos músculos estarem muito fracos
Pode haver ausência de sensibilidade em toda a área da fraqueza muscular
A sensibilidade (como ao tato e ao calor) encontra-se normal, mas os músculos podem doer à pressão
A incapacidade do músculo de relaxar (miotonia) comumente indica um problema muscular, mais que dos nervos. O exame neurológico minucioso auxilia na identificação de qualquer alteração da sensibilidade, da coordenação, dos movimentos motores finos e dos reflexos. Os estudos neurológicos (p.ex.,mensuração da condução nervosa) ajudam a determinar a normalidade do funcionamento da inervação dos músculos. O eletromiograma, exame no qual são registrados os impulsos elétricos provenientes dos músculos, ajuda a determinar se eles estão normais.
Se os músculos estiverem anormais, a eletromiografia ajuda a diferenciar entre uma anormalidade primária da inervação e uma anormalidade muscular primária. Se o problema for localizado no próprio músculo, o médico realiza uma biópsia muscular (coleta de um pequeno fragmento de músculo para exame microscópico). Os exames de sangue incluem a velocidade de hemossedimentação, que pode estar elevada se houver inflamação presente, e a dosagem da creatino cinase, uma enzima muscular normal que pode extravasar do músculo e passar para a corrente sangüínea quando existe uma lesão muscular.
Distrofia Muscular e Distúrbios Relacionados
As distrofias musculares são um grupo de distúrbios musculares hereditários que acarretam fraqueza muscular de gravidade variável. Outros distúrbios musculares hereditários incluem as miopatias miotônicas, as doenças de depósito de glicogênio e a paralisia periódica.
Distrofias Musculares de Duchenne e de Becker
As distrofias musculares de Duchenne e de Becker – as distrofias musculares mais comuns – são doenças que causam fraqueza dos músculos mais próximos do tronco. O defeito genético da distrofia muscular de Duchenne é diferente do da distrofia muscular de Becker, mas o gene afetado é o mesmo em ambas. O gene é recessivo e ligado ao cromossomo X. Mesmo quando uma mulher é portadora do gene defeituoso, ela não apresenta a doença porque o cromossomo X normal compensa a anomalia genética do outro cromossomo X. Por outro lado, qualquer homem que receba o cromossomo X defeituoso apresentará a doença. Os meninos com distrofia muscular de Duchenne apresentam uma falta quase total de uma proteína muscular essencial, a distrofina, a qual, acredita-se, é importante para a manutenção da estrutura das células musculares. A distrofia muscular de Duchenne afeta de 20 a 30 meninos em cada 100.000 nascimentos. Os meninos com a distrofia muscular de Beker produzem distrofina, mas a proteína é maior que o normal e não funciona adequadamente. A distrofia muscular de Becker afeta 3 em cada 100.000 meninos.
Sintomas
Normalmente, a distrofia muscular de Duchenne manifesta-se pela primeira vez em meninos com idade entre três e sete anos, sob a forma de uma fraqueza muscular na região pélvica ou em torno dessa região. Comumente, o indivíduo apresenta a seguir fraqueza da musculatura dos ombros, a qual torna-se progressivamente pior. À medida que os músculos enfraquecem, eles também aumentam de volume, mas o tecido muscular anormal não é forte. Em 90% dos meninos com distrofia muscular de Duchenne, o miocárdio também aumenta de volume e enfraquece, acarretando distúrbios do ritmo cardíaco, que são detectados no eletrocardiograma. Os meninos afetados pela distrofia muscular de Duchenne geralmente apresentam uma marcha vacilante, sofrem quedas freqüentes, apresentam dificuldade para subir escadas e levantar- se da posição sentada.
Os músculos dos membros superiores e inferiores podem apresentar contraturas em torno das articulações, impedindo a extensão completa dos cotovelos e dos joelhos. Algumas vezes, ocorre a formação de uma curvatura anormal na coluna vertebral (escoliose). Em torno dos 10 ou 12 anos de idade, a maioria das crianças com essa doença encontra- se confinada a uma cadeira de rodas. O aumento da fraqueza também as torna suscetíveis à pneumonia e a outras doenças, e a maioria morre por volta dos 20 anos de idade. Embora os sintomas sejam similares em ambos os tipos de distrofia, os meninos com a distrofia muscular de Becker apresentam uma doença menos grave. Os sintomas ocorrem pela primeira vez em torno dos 10 anos de idade. Aos 16 anos, pouquíssimos pacientes encontram-se confinados a uma cadeira de rodas e mais de 90% ainda permanecem vivos aos 20 anos de idade.
Diagnóstico
O médico suspeita de uma distrofia muscular quando um menino apresenta fraqueza e esta é progressiva. Uma enzima (creatinina cinase) sai das células musculares, aumentando acentuadamente a sua concentração no sangue. No entanto, concentrações elevadas de creatinina cinase não significam necessariamente que a criança apresenta uma distrofia muscular, uma vez que outras doenças musculares também podem causar aumento da concentração sérica dessa enzima. O médico costuma realizar uma biópsia muscular – na qual um pequeno fragmento do músculo é removido para ser submetido ao exame microscópico – para certificar-se do diagnóstico. Ao microscópio, o músculo comumente apresenta tecido morto e fibras musculares anormalmente grandes. Nos últimos estágios da distrofia muscular, o tecido adiposo e outros tecidos substituem o tecido muscular. A distrofia muscular de Duchenne é diagnosticada quando alguns exames especiais demonstram níveis extremamente baixos da proteína distrofina no músculo. Os exames que confirmam o diagnóstico consistem em estudos elétricos da função muscular (eletromiografia) e estudos da condução dos nervos.
Outras Distrofias Musculares
Várias formas muito menos comuns de distrofia muscular, todas hereditárias, também causam fraqueza muscular progressiva. A distrofia muscular de Landouzy-Dejerine é transmitida por um gene autossômico dominante; portanto, somente um gene anormal é responsável pela doença, que pode ser observada indistintamente em homens ou mulheres. A distrofia muscular de Landouzy-Dejerine normalmente se inicia entre os 7 e os 20 anos de idade. Os músculos faciais e os dos ombros sempre são afetados e, conseqüentemente, o indivíduo apresenta dificuldade para levantar os membros superiores, assobiar ou fechar os olhos. Alguns também apresentam fraqueza nas pernas, com conseqüente dificuldade de realizar a flexão dorsal dos pés ao nível do tornozelo, acarretando o pé caído.
A fraqueza da distrofia muscular de Landouzy-Dejerine raramente é grave e os indivíduos que a apresentam têm uma expectativa de vida normal. As distrofias musculares das cinturas escapular e pélvica causam fraqueza da musculatura pélvica (distrofia muscular de Leyden-Möbius) ou do ombro (distrofia muscular de Erb). Essas doenças hereditárias geralmente aparecem na vida adulta e, raramente, produzem fraqueza muscular grave. As miopatias mitocondriais são distúrbios musculares herdados quando genes defeituosos das mitocôndrias (produtoras de energia celular) passam através do citoplasma do óvulo da mãe. As mitocôndrias possuem seus próprios genes. Como os espermatozóides não contribuem com mitocôndrias durante a fertilização, todos os genes mitocondriais são provenientes da mãe. Portanto, essas doenças nunca podem ser herdadas do pai. Algumas vezes, esses distúrbios raros produzem uma fraqueza progressiva de apenas um grupo muscular como, por exemplo, dos músculos dos olhos (oftalmoplegia).
Miopatias Miotônicas
As miopatias miotônicas são um grupo de distúrbios hereditários caracterizados pela incapacidade dos músculos relaxarem geralmente após a contração, podendo acarretar fraqueza muscular, espasmos musculares e encurtamento dos músculos (contraturas). A distrofia miotônica (doença de Steinert) é um distúrbio autossômico dominante que afeta homens e mulheres. O distúrbio produz fraqueza e contratura muscular, especialmente nas mãos. A ptose palpebral (queda da pálpebra) também é comum. Os sintomas podem ocorrer em qualquer idade, variando de leves a graves. Os indivíduos com a forma mais grave da doença apresentam uma fraqueza muscular extrema e vários outros sintomas como, por exemplo, catarata, atrofia testicular, calvície prematura, arritmias cardíacas (batimentos cardíacos irregulares), diabetes e retardo mental.
Esses indivíduos normalmente morrem em torno dos 50 anos. A miotonia congênita (doença de Thomsen) é um distúrbio autossômico dominante raro que afeta homens e mulheres. Habitualmente, os sintomas começam na infância. As mãos, as pernas e as pálpebras tornam-se muito rígidas devido ao fato de os músculos serem incapazes de relaxar. No entanto, a fraqueza muscular geralmente é mínima. O diagnóstico é estabelecido baseandose nas características físicas da criança, na incapacidade de relaxar a pegada da mão rapidamente e na contração prolongada após o médico percutir um músculo. É necessária a realização de uma eletromiografia para confirmar o diagnóstico. A doença de Thomsen é tratada com a fenitoína, a quinina, a procainamida ou a nifedipina para aliviar a rigidez e as câimbras musculares. No entanto, esses medicamentos apresentam efeitos colaterais indesejáveis. O exercício regular pode ser benéfico. Os indivíduos com doença de Thomsen apresentam uma expectativa de vida normal.
Doenças de Depósito de Glicogênio
As doenças de depósito de glicogênio são um grupo de distúrbios hereditários autossômicos recessivos, caracterizados pelo acúmulo anormal de glicogênio (um amido) nos músculos porque estes não conseguem metabolizar os açúcares normalmente. A forma mais grave é a doença de Pompe, que se manifesta no primeiro ano de vida. O glicogênio acumula-se no fígado, nos músculos, nos nervos e no coração, impedindo o seu funcionamento adequado. A língua, o coração e o fígado aumentam de tamanho. As crianças com doença de Pompe apresentam uma musculatura flácida quando lactentes e tornam-se progressivamente mais fracas. Elas apresentam dificuldade de deglutição e respiração. A doença de Pompe não tem cura. A maioria dos lactentes com a doença morre até os 2 anos de idade. Crianças maiores e adultos podem apresentar formas menos graves da doença, que causam fraqueza de membros superiores e inferiores e reduzem a capacidade de respirar profundamente.
Os indivíduos com outras formas de doença de depósito de glicogênio apresentam câimbras dolorosas e fraqueza muscular, geralmente após a realização de exercícios. Esses sintomas podem variar de muito discretos até graves. A não realização de exercícios permite que os sintomas desapareçam. A lesão muscular produz a liberação da proteína mioglobina para o interior da corrente sangüínea. Como a mioglobina é excretada na urina, um exame de urina pode detectar a sua presença e auxiliar no estabelecimento do diagnóstico de uma doença de depósito de glicogênio. A mioglobina pode lesar os rins. A limitação do exercício reduz a concentração de mioglobina. A ingestão de uma grande quantidade de água, especialmente depois de um esforço intenso, pode diluir a concentração de mioglobina. Quando esta encontra-se elevada, o médico pode prescrever diuréticos para evitar a ocorrência de lesão renal. Um transplante de fígado pode ajudar os indivíduos com outras doenças de acúmulo de glicogênio que não a doença de Pompe.
Paralisia Periódica
A paralisia periódica descreve um grupo de distúrbios hereditários autossômicos dominantes raros e relacionados, os quais causam episódios súbitos de fraqueza e paralisia. Durante um episódio de paralisia periódica, os músculos não respondem aos impulsos nervosos normais nem à estimulação artificial com o auxílio de um instrumento eletrônico. Os episódios diferem das convulsões porque o indivíduo permanece totalmente consciente e alerta. A forma como a doença manifesta-se varia em diferentes famílias. Em algumas, a paralisia está relacionada a concentrações elevadas de potássio no sangue (hipercalemia); em outras, a paralisia está relacionada a concentrações baixas de potássio (hipocalemia).
Sintomas
No dia seguinte a um exercício intenso, o indivíduo pode despertar com uma sensação de fraqueza. Esta pode ser leve e ser limitada à musculatura dos membros. Geralmente, a fraqueza dura um ou dois dias. Na forma hipercalêmica, os episódios freqüentemente começam em torno dos 10 anos de idade e sua duração varia de 30 minutos a 4 horas. Na forma hipocalêmica, os primeiros episódios normalmente manifestamse pela primeira vez na segunda década de vida e sempre por volta dos 30 anos. A sua duração é maior e eles são mais graves. Alguns indivíduos com a forma hipocalêmica apresentam uma propensão a episódios de paralisia no dia que sucede a uma ingestão de alimentos ricos em carboidratos. No entanto, o jejum também pode desencadear um episódio.
MIOPATIAS CONGÊNITAS
As miopatias congênitas são doenças musculares que se apresentam ao nascimento decorrentes de defeitos em genes que codificam proteínas musculares. A perda ou disfunção dessas proteínas leva ao aparecimento de características morfológicas específicas nos músculos, que podem ser observadas em estudos ao microscópio (biópsia).
As miopatias congênitas são classificadas de acordo com essas características morfológicas. Por exemplo, se observamos na biópsia uma área central clara (sem atividade oxidativa) no tecido muscular corado por um corante especial, a miopatia congênita é do tipo central core).
Características Gerais
Suspeita-se do diagnóstico de miopatia congênita diante de um recém-nascido hipotônico (flácido), com dificuldade para sugar, para respirar e fraqueza muscular generalizada. Pode haver relato de movimentos fetais diminuídos e aumento do líquido amniótico. Esse diagnóstico pode ser também pensado nos casos de atraso nas aquisições motoras (segurar a cabeça, sentar, andar), principalmente se associado a hipotonia no período neonatal.
Algumas manifestações clínicas como ptose palpebral (pálpebra superior caída), rosto alongado, micrognatia (maxilar inferior pequeno), fraqueza da musculatura facial, palato ogival (céu da boca elevado), músculos pouco desenvolvidos, presença de deformidades esqueléticas, como luxação congênita de quadril, pé torto ao nascer e artrogripose (deformidades articulares múltiplas presentes ao nascimento), sugerem o diagnóstico de miopatia congênita.
Contudo, existem casos de miopatia congênita com manifestações clínicas iniciadas somente na idade adulta com fraqueza muscular proximal.
Incidência
A incidência das miopatias congênitas é desconhecida. Em uma série de crianças que apresentaram hipotonia neonatal e que foram submetidas a biópsia muscular antes de dois meses de vida, as miopatias congênitas foram encontradas em 14%.
A freqüência de cada tipo de miopatia congênita é variada. Em uma série de 180 casos reunidos ao longo de 20 anos, observou-se a seguinte distribuição: miopatia nemalínica (20%), central core (16%), centronuclear (14), multicore (10%), desproporção por tipo de fibras (21%) e miscelânea (19%).
Hereditariedade
As miopatias congênitas são hereditárias e em geral, apresentam herança autossômica dominante (basta que um dos pais seja portador do gene) e passam de pai ou mãe para filho, independente do sexo, com risco de ocorrência igual a 50% em cada gestação; ou autossômica recessiva com pais sadios (a doença se manifesta com o encontro de dois genes para a doença, um do pai e outro da mãe) com risco de ocorrência igual a 25% em cada gestação.
Em algumas miopatias congênitas, como na central core, já se conhece o defeito genético. Nesse tipo de miopatia, em cerca de 50% dos casos encontra-se uma mutação em um gene do cromossomo 19.
Existem também miopatias congênitas, como a nemalínica, que podem apresentar diferentes tipos de herança associadas a diferentes mutações em proteínas musculares distintas.
Prognóstico
Na verdade, é bastante variado. Existem algumas miopatias congênitas, como a centronuclear, que tem forma de apresentação neonatal mais grave e evolui com insuficiência respiratória precoce no primeiro ano de vida, e formas que se apresentam na infância ou mesmo na idade adulta, com fraqueza muscular de predomínio proximal, progressão lenta, com marcha independente até a 5ª ou 6ª década.
É importante lembrar que as miopatias congênitas podem estar associadas a cardiomiopatia (doença do músculo do coração) e a hipertermia maligna. A hipertermia maligna está associada principalmente à miopatia tipo central core. Ela se caracteriza por elevação rápida e incontrolável da temperatura corporal (que pode atingir valores tão elevados quanto 44ºC), associada à contratura muscular difusa, cianose (pele azulada por diminuição da oxigenação dos tecidos), acidose e freqüência cardíaca elevada. Seguem-se mioglobinúria (eliminação urinária de mioglobulina, pigmento protéico do músculo), hiperpotassemia, insuficiência renal, arritmia cardíaca e hipotensão arterial. A hipertermia maligna é geralmente desencadeada por exposição a agentes anestésicos.
Principais Miopatias Congênitas
Miopatia Tipo Central Core
Genética
Herança autossômica dominante com penetrância variável. Em cerca de 80% dos casos, a miopatia tipo central core está relacionada a mutações em geral localizadas no braço longo do cromossomo 19. Mutações no mesmo gene foram também associadas a outros tipos de miopatia congênita (com cores e rods, central core e hipertermia maligna, e central core com corpos de inclusão tipo impressões digitais).
Manifestações clínicas
Formas neonatais: hipotonia, atraso nas aquisições, fraqueza difusa, com acometimento facial discreto, ausência dos reflexos profundos. Formas tardias: graus variáveis de fraqueza muscular proximal, podendo a pessoa com este tipo de problema referir cãimbras e intolerância aos esforços. As enzimas musculares são normais ou pouco elevadas.
Eletroneuromiografia
Pode ser normal ou demonstrar padrão miopático ou neurogênico.
Biópsia Muscular
A microscopia óptica (microscópio comum) demonstra estrutura geral do músculo preservada e áreas arredondadas bem delimitadas, com falta de atividade enzimática oxidativa, que se estendem por quase toda a extensão da fibra muscular do tipo I. Microscopia eletrônica: ausência de mitocôndrias (organelas citoplasmáticas que produzem energia para a célula através de respiração celular), diminuição do volume do sarcoplasma (citoplasma da fibra muscular estriada), irregularidades da linha Z (banda escura de uma fibra muscular estriada que marca a junção dos filamentos de actina adjacentes aos sarcômeros).
Miopatia Nemalínica
Genética
Heterogeneidade genética (vários tipos de herança). A miopatia nemalínica está relacionada a várias mutações relacionadas a genes localizados nos cromossomos 21, 9 e 19.
Manifestações clínicas
Forma neonatal: movimentos fetais diminuídos, polihidrâmnio (aumento do líquido amniótico), hipotonia, insuficiência respiratória, fraqueza facial e deformidades articulares presentes ao nascimento. Forma infantil clássica: hipotonia, atraso do desenvolvimento motor, face alongada e inexpressiva, ptose palpebral (pálpebra caída), céu da boca alto, escoliose (desvio lateral da coluna), retração dos tendões e raramente cardiomiopatia (doença do músculo do coração). Forma adulta: insuficiência respiratória por fraqueza do diafragma (músculo que divide o tórax do abdome e participa na respiração) e alterações ortopédicas). Forma benigna : fraqueza muscular difusa.
Biópsia Muscular
Microscopia óptica: presença de bastões (rods) subsarcolemais, intermiofibrilares ou intranucleares. Os bastões são estruturas vermelhas, brilhantes e alongadas no Gomori (corante). Estão presentes em fibras do tipo I ou em ambos os tipos. A quantidade de bastões pode variar em diferentes músculos e não se relaciona com a gravidade do quadro clínico. Microscopia eletrônica: estrutura densa que se prolonga com miofibrilas e linhas Z.
Miopatia Centronuclear
Herança
Autossômica dominante.
Manifestações Clínicas
Oftalmoparesia (paralisia ocular parcial) hipertrofia de panturrilhas, alterações cognitivas e dor.
Eletroneuromiografia
Descargas pseudomiotônicas (que têm início e término abrupto no traçado).
Biópsia muscular
Centralização nuclear (35 a 90% das fibras), em geral núcleos únicos, raramente múltiplos, tamanho da fibra próximo ao normal, citoplasma perinuclear pouco abundante, disposição radiada.
Miopatia Miotubular
Genética
Mutação no cromossomo 28. Existem cerca de 141 mutações descritas.
Manifestações Clínicas
Forma neonatal grave: polihidrâmnio, óbito neonatal, hipotonia grave, poucos movimentos, luxação de quadril, oftalmoparesia, fraqueza facial. Pode haver complicações hepáticas, endócrinas e hematológicas (esferocitose). Heterozigotas podem ser assintomáticas ou apresentarem fraqueza muscular de cinturas (pélvica e escapular), fraqueza facial, disartria e cifoescoliose.
Biópsia Muscular
Fibras musculares imaturas, pequenas, arredondadas, com grande núcleo central. Concentração central de atividade oxidativa, com halo claro entre o núcleo e a periferia.
Desproporção por Tipo de Fibras
Herança
Não definida
Manifestações Clínicas
Hipotonia, atraso do desenvolvimento motor, face alongada e alterações ortopédicas múltipas precoces e graves. A doença não é progressiva.
Biópsia Muscular
Existem dois tipos de fibras esqueléticas (fibras que formam os músculos): fibras caracterizadas por tempo de contração lento (Tipo I) e por tempo de contração rápido (Tipo II). Na desproporção por tipo de fibras existe predomínio de fibras do tipo I (80%).
Mini-multicores
Herança
Autossômica recessiva
Formas
Precoces e tardias.
Manifestações clínicas
Estudos de séries de casos demonstraram quatro tipos diferentes:
a)Fraqueza axial, escoliose, insuficiência respiratória, frouxidão dos ligamentos e miopia.
b)Oftalmoparesia (paralisia incompleta do olho), fraqueza facial grave e fraqueza muscular generalizada.
c)Início precoce (com deformidades articulares múltiplas presentes ao nascimento).
d)Fraqueza lentamente progressiva com atrofia das mãos, envolvimento faringolaríngeo e falta de controle cervical. Cifoescoliose (desvio da coluna) e miocardiopatia. Progressão lenta ou estável.
Biópsia Muscular
Microscopia óptica (microscópio comum): múltiplas áreas pouco coradas, com extensão longitudinal por parte da fibra. Compromete fibras do tipo I e do tipo II. Microscopia eletrônica: áreas sem mitocôndrias, desestruturação das miofibrilas e estriações das estrias Z.
Existem várias outras miopatias congênitas mais raras, por vezes descritas em famílias isoladas.
REFERÊNCIAS BIBLIOGRÁFICAS
DOWNIE, Patrícia A. Neurologia para Fisioterapeutas.São Paulo: Panamericana,1987.
GALHARDO, Ivanilton. Propedêutica Neurológica Essencial. São Paulo: Pancast, 1989.
ATROFIA ESPINHAL . Disponível em: < http://www.montrealnet.com.br/atrofiaespinhal/Doenca.htm> acessado em 07/04/2008.
MIOPATIA CONGÊNITA. Disponível em <http://genoma.ib.usp.br/estud_miopatias_congenitas.php> acessado em 10/05/2008.
MIOPATIA MITOCONDRIAL. Disponível em <http://genoma.ib.usp.br/estud_miopatias_congenitas.php> acessado em 06/05/2008.
MIOPATIA EXPERIMENTAL. Disponível em <http://www.geocities.com/miopatia_experimental/miopatia.html> acessado em 06/05/2008.
Assinar:
Postagens (Atom)






