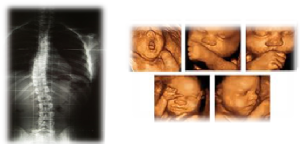
Deficiência congênita de leptina é uma forma de obesidade monogênica caracterizada por obesidade precoce grave e marcado hiperfagia. Tem sido descrito em menos de 30 pacientes. Os pacientes com deficiência congênita de leptina estão gravemente hiperfágicos desde a primeira infância e, embora o peso ao nascer é normal, eles rapidamente se tornam obesas durante a infância.Um aumento da susceptibilidade às infecções, também tem sido relatado na estas lactentes e parece estar associado com a diminuição do número de células CD4 + circulantes, células T e a proliferação de células T diminuída e libertação de citoquinas. Outras características da doença incluem a hiperinsulinemia, a idade óssea avançada, hipotiroidismo hipotalâmico e hipogonadismo hipogonadotrófico conduzindo a uma falha de se submeter a puberdade. A leptina é uma hormona derivada de adipócitos que desempenha um papel importante no equilíbrio da energia e a supressão do apetite. Embora a maioria dos pacientes obesos visor hyperleptinaemia, pacientes com deficiência congénita de leptina têm níveis indetectáveis de leptina no soro. Esta ausência de leptina sérica é causada por frameshift homozigoto ou mutações missense no ob gene (7q31.3) e é herdada como traço autossômico recessivo. No entanto, um fenótipo semelhante foi observada em três indivíduos de uma família consanguínea que realizaram mutações homozigóticas no gene que codifica o receptor da leptina ( do receptor da leptina , 1p31). A história da família, hiperfagia e obesidade grave de início precoce pode levar à suspeita de síndrome de obesidade monogênica. O diagnóstico da deficiência congénita de leptina pode ser confirmada através de análise dos níveis de leptina no soro ou a identificação de mutações no ob gene.Deficiência congênita de leptina pode ser tratada com sucesso com injeções subcutâneas diárias de leptina recombinante humana, resultando em efeitos positivos sustentados na perda de peso, reduzindo o apetite, desenvolvimento puberal adequados e hiperinsulinemia. Como resultado, o prognóstico para os doentes submetidos a tratamento parece ser excelente. No entanto, os pacientes diagnosticados estão em risco de desenvolver complicações normalmente associados com a obesidade severa (em especial diabetes do tipo 2), com o prognóstico sendo ainda mais prejudicada por um aumento da taxa de mortalidade devido à infecção na infância.
PARCERIAS
▼
sexta-feira, 31 de maio de 2013
DEFICIÊNCIA DA BIOTINIDASE
O QUE É A DEFICIÊNCIA DA BIOTINIDASE?
(Colaboração da Dra. Eugênia Ribeiro Valadares e Dra. Carolina F. Moura Souza)
A DEFICIÊNCIA DA BIOTINIDASE é uma doença metabólica tratável na qual o organismo não consegue obter a vitamina BIOTINA da maneira adequada. O diagnóstico precoce com o início do tratamento ainda nos primeiros meses de vida, assegura ao bebê uma vida normal sem qualquer sintoma da doença.
O corpo humano é muito complexo. Dentro dele, milhares de reações químicas ocorrem envolvendo os alimentos que ingerimos, o ar que respiramos, a nossa adaptação ao meio ambiente e o nosso crescimento e desenvolvimento. Algumas destas reações químicas permitem que alimentos sejam processados ou metabolizados para serem utilizados pelo nosso organismo.
As enzimas são proteínas especiais produzidas pelo organismo para permitirem que as reações químicas ocorram. Enzimas com função adequada são chamadas ativas ou com atividade. Algumas enzimas precisam de vitaminas para serem ativas. Freqüentemente uma única enzima ativa atua no fornecimento de substâncias diversas que o nosso organismo precisa.
Algumas vezes o organismo não produz uma determinada enzima em quantidade suficiente ou a enzima que é fabricada não trabalha adequadamente. Isto faz com que a enzima tenha uma redução da sua atividade e não funcione como deveria. Outras reações químicas que dependem desta enzima também podem estar prejudicadas.
Se a atividade da enzima é inferior a 10% de sua atividade normal ela é considerada deficiente.Normalmente deficiências enzimáticas acarretam problemas médicos. Problemas de saúde decorrente de uma enzima deficiente são chamadas doenças metabólicas porque o metabolismo ou os processos químicos do organismo não está acontecendo normalmente.
A biotinidase é uma importante enzima no nosso organismo. Pessoas com deficiência da biotinidase não possuem atividade da biotinidase suficiente (Figura 01). Indivíduos com deficiência da biotinidase possuem a atividade da enzima inferior a 10% do normal e às vezes não têm nenhuma atividade. Estas pessoas com atividade da biotinidase inferior a 10% da média normal têm deficiência profunda de biotinidase. Os pais de crianças com deficiência da biotinidase têm aproximadamente 50% da atividade normal da biotinidase, o que é suficiente para prevenir problemas de saúde. As pessoas que possuem a atividade da biotinidase entre 10 e 30% do normal possuem deficiência parcial de biotinidase. As duas formas requerem tratamento. A figura abaixo ilustra os percentuais de atividades da biotinidase no sangue e os compara com a atividade normal.

A biotinidase é uma importante enzima no ciclo da biotina, cadeia de reações químicas envolvidas na utilização e reutilização da vitamina biotina, como mostra a Figura 02. Uma importante tarefa da biotinidase é de separar ou liberar a biotina das proteínas dos alimentos. Além disso, a biotinidase permite que o organismo recicle a biotina várias vezes para que não haja necessidade de consumirmos grande quantidade desta vitamina na nossa dieta diária.

A biotina livre é necessária para que um grupo de enzimas chamado carboxilases funcione perfeitamente. Carboxilases são importantes no metabolismo de algumas gorduras, carboidratos e proteínas. Para que a carboxilases inativa se torne ativa, a biotina livre deve estar anexada ao aminoácido, lisina, em um local especifico da carboxilase inativa.
Eventualmente as carboxilases são degradadas, mas a biotina fica anexada na lisina. Este complexo biotina-lisina é conhecido como biocitina. Biocitina é normalmente degradada pela biotinidase em biotina livre e lisina. Deste modo, biotina é reciclada e pode ser reutilizada pela carboxilases.
Quando a atividade da biotinidase é deficiente a biotina que está contida nos alimentos não pode ser utilizada pela carboxilases. As carboxilases são incapazes de exercer suas funções normais. Sem a atividade adequada da biotinidase, o organismo precisa de grandes quantidades de biotina livre, mais do que o consumido em uma dieta normal. Quando não há biotina disponível no organismo começam a surgir problemas de saúde.
Uma pergunta freqüente é: como a deficiência da biotinidase afeta minha criança?
SEM O TRATAMENTO
Sem a ingestão de biotina, crianças com deficiência da biotinidase podem desenvolver um ou mais dos sintomas abaixo relacionadas:
- Alopécia (queda de cabelo);
- Atraso de desenvolvimento; - Hipotonia; - Aciduria lática; - Convulsões; - Erupções de pele/ infecções de pele; - Ataxia; - Conjuntivite; - Perda de audição; - Letargia; - Hiperamonêmia leve; - Problemas respiratórios; - Problemas de visão; - Coma; - Dificuldade para alimentação; - Infecções fúngicas; - Hepatomegalia (aumento do fígado); - Problemas de fala; - Esplenomegalia (aumento do baço).
Os sintomas normalmente se manifestam entre o terceiro e o sexto mês de vida, mas podem aparecer mais cedo, como por exemplo, com uma semana de vida ou mais tarde, com dez anos de idade. O número de sintomas que uma criança desenvolve e a seriedade do distúrbio pode variar de criança para criança, mesmo sendo da mesma família.
Os sintomas iniciais da deficiência da biotinidase geralmente incluem convulsões de vários tipos, especialmente convulsões mioclônicas, e hipotonia. Estes sintomas não são exclusivos da deficiência da biotinidase, mas são uma pista para investigá-la. Outros sintomas que ocorrem precocemente incluem taquipnéia (respiração rápida), hiperventilação, estridor (respiração ruidosa), apnea, erupções de pele, seborréia ou dermatite atópica, queda parcial ou completa de cabelo, conjuntivite, atraso no desenvolvimento mental. A ataxia e o atraso no desenvolvimento são observados na evolução da doença. O sistema imune aparentemente se altera e infecções virais e bacterianas podem ocorrer em crianças sem tratamento. A perda da audição costuma ser neurosensorial e problemas de visão, prinicipalmente atrofia ótica, podem surgir. Metabólitos podem ficar acumulados anormalmente causando danos permanentes a órgãos como cérebro, pele, ouvido e olhos. Crianças que não recebem tratamento adequado podem vir a óbito precocemente.
De acordo com uma pesquisa feita pelo Dr. Barry Wolf* 95% das crianças que apresentaram algum tipo de sintoma tem também algum grau de perda de audição. Portanto se o seu filho/paciente apresentou algum dos sintomas listados acima, convém efetuar um teste de audição. Se o seu filho não apresentou nenhum sintoma e foi medicado nas primeiras semanas de vida o exame não é necessário.
A deficiência da biotinidase não diagnosticada e tratada pode ser considerada uma das causas da Síndrome da Morte Súbita na Infância, apesar de serem necessárias mais informações nesta área.
COM TRATAMENTO:
Todas as crianças que desenvolveram os sintomas da deficiência da biotinidase tiveram significativas e rápidas melhoras com o inicio da ingestão de biotina.
As crianças que fizeram o teste de triagem neonatal (Teste do Pezinho) e iniciaram o tratamento precocemente, até a presente data, não desenvolveram nenhum dos sintomas.
|
Hiperplasia Adrenal Congênita
Hiperplasia Adrenal Congênita
1 METODOLOGIA DE BUSCA DA LITERATURA
Utilizando-se como estratégia de busca no Medline/Pubmed os termos “Adrenal Hyperplasia,
Congenital”[Mesh] e “Diagnosis”[Mesh]) e “Therapeutics”[Mesh] e restringindo-se para artigos em humanos
publicados nos últimos 10 anos, resultaram 50 artigos. Na mesma base de dados, utilizando-se a estratégia
de busca “Adrenal Hyperplasia, Congenital”[Mesh] e Clinical Trials e restringindo-se para artigos em humanos
publicados nos últimos 10 anos, foram encontrados outros 50 artigos. Todos os trabalhos foram revisados, e
os 22 identificados como de interesse foram incluídos no protocolo. Também foram consultados livros-texto
de Endocrinologia.
2 INTRODUÇÃO
Adenominação hiperplasia adrenal congênita (HAC) engloba um conjunto de síndromes transmitidas
de forma autossômica recessiva1,2 que se caracterizam por diferentes deficiências enzimáticas na síntese
dos esteroides adrenais. A incidência de HAC é variável entre diferentes populações, com incidência da
forma perdedora de sal variando de 1:2803
a 1:42.000 nascidos vivos4
. No Brasil, a incidência desta forma
parece oscilar de 1:7.5005
a 1:10.000 nascidos vivos6
.As deficiências enzimáticas mais comuns em HAC são:
21-hidroxilase (CYP21A2), que responde por cerca de 95% dos casos2
, e 11-beta-hidroxilase (CYP11B1),
encontrada em aproximadamente 5% dos casos.Ambas estão envolvidas na rota de síntese do cortisol e da
aldosterona. Casos muito raros de HAC por deficiência nas enzimas 20,22-desmolase (CYP11A1), 17-alfahidroxilase (CYP17), 3-beta-hidroxiesteroide-desidrogenase (HSD3B2), aldosterona sintase (CYP11B2) e
hiperplasia lipoide (StAR) podem ocorrer.
As manifestações clínicas das HACs dependem da enzima envolvida e do grau de deficiência
enzimática (total ou parcial). A apresentação clínica pode se expressar por insuficiência glicocorticoide
(deficiência na síntese de cortisol), insuficiência mineralocorticoide (deficiência na síntese da aldosterona) ou
por excesso de andrógenos (desvio da rota de síntese hormonal, com aumento de síntese dos precursores
androgênicos). Em casos de HAC por deficiência das enzimas 11-beta-hidroxilase e 17-alfa-hidroxilase, o
acúmulo dos precursores pregnenolona e progesterona pode ocasionar desvio na rota e aumento na síntese
do mineralocorticoide desoxicorticosterona, com consequente hipertensão e hipopotassemia. As síndromes
clínicas mais frequentes de HAC podem ser divididas em 3 formas: forma clássica perdedora de sal, forma
clássica não perdedora de sal e forma não clássica.
Forma clássica perdedora de sal
Constitui a forma mais comum de HAC clássica (60% dos casos). Nos recém-nascidos do sexo
feminino, há virilização da genitália externa (aumento de clitóris, fusão labial e formação de seio urogenital),
decorrente do excesso de andrógenos durante a vida intrauterina. Nos recém-nascidos do sexo masculino
e nos do sexo feminino nos quais a virilização da genitália externa não foi identificada, como há deficiência
mineralocorticoide, a apresentação ocorre nos primeiros dias de vida com crise adrenal: depleção de volume,
desidratação, hipotensão, hiponatremia e hiperpotassemia.
Consultores: José Miguel Dora, Regina Helena Elnecave, Bárbara Corrêa Krug e Karine MedeirosAmaral
Editores: Paulo Dornelles Picon, Maria Inez Pordeus Gadelha eAlberto Beltrame
Os autores declararam ausência de conflito de interesses.
357Protocolos Clínicos e Diretrizes Terapêuticas
Forma clássica não perdedora de sal (virilizante simples)
Nos recém-nascidos do sexo feminino, há virilização da genitália externa. Como nesta forma não há
deficiênciamineralocorticoidecomrepercussãoclínica,osrecém-nascidosdosexomasculinosãofrequentemente
identificadosemidadetardiapor sinaisde hiperandrogenismo: velocidadedecrescimentoaumentada,maturação
óssea acelerada ou pubarca precoce.
Forma não clássica (de início tardio)
Esta forma de apresentação é cerca de 15 vezes mais frequente do que a forma clássica de HAC7
.
Os pacientes frequentemente são assintomáticos ou as manifestações se apresentam tardiamente na infância
ou adolescência. No sexo feminino, devido ao hiperandrogenismo decorrente da deficiência enzimática, a
apresentação pode ser por aumento de clitóris, pubarca precoce, ciclos menstruais irregulares e hirsutismo. No
sexo masculino, o quadro costuma ser assintomático.
3 ClassiFiCação EstatístiCaintErnaCional dE doEnças E problEmas rElaCionados à
saúdE (Cid-10)
• E25.0 Transtornos adrenogenitais congênitos associados a deficiência enzimática
4 DIAGNÓSTICO
4.1 ClíniCo
Emrecém-nascidosdosexofeminino,odiagnósticodaformaclássicadeHACésuspeitadopelapresença
de virilização da genitália externa. Já em recém-nascidos do sexo masculino, o diagnóstico clínico é dependente
do grau de deficiência mineralocorticoide.Aforma perdedora de sal apresenta-se nos primeiros dias de vida com
desidratação, hipotensão, taquicardia, vômitos, perda de peso, letargia, hiponatremia e hiperpotassemia. No
sexo masculino, a forma não perdedora de sal (virilizante simples) apresenta-se mais tardiamente, com pubarca
precoce, velocidade de crescimento aumentada ou maturação óssea acelerada2
.
O diagnóstico de HAC forma não clássica deve ser considerado em pacientes do sexo feminino com
sintomas ou sinais de hiperandrogenismo. Os do sexo masculino com diagnóstico de HAC forma não clássica
são geralmente assintomáticos. Entretanto, alguns deles, com tecido adrenal ectópico em testículo, podem
apresentar aumento do volume testicular e oligospermia.
4.2 laboratorial
As deficiências enzimáticas de HAC, na síntese do cortisol e da aldosterona, levam ao acúmulo de
metabólitos precursores, dentre os quais 17-OH-progesterona.
Forma clássica
A dosagem de 17-OH-progesterona é utilizada como forma de rastreamento neonatal através do teste
do pezinho8
. Em neonatos, os valores dependem da idade gestacional ao nascimento9
, da idade de coleta do
material para exame10
, do peso ao nascimento10 e do sexo11
. O uso de glicocorticoide antenatal pela mãe, devido
a sua passagem transplacentária, pode suprimir a produção de 17-OH-progesterona no neonato, ocasionando
resultados falso-negativos12
. Os valores de referência para ponto de corte para rastreamento de HAC variam de
15 a 40 ng/ml.
Pacientes com rastreamento positivo para HAC por papel filtro devem confirmar o resultado através de
dosagem de 17-OH-progesterona em sangue periférico. Em neonatos, valores de 17-OH-progesterona < 10 ng/ml
excluem HAC.Pacientes com HACgeralmente apresentam dosagem de 17-OH-progesterona>35 ng/ml, sendo que
resultados acima de 100 ng/ml, vistos na maioria dos pacientes com a forma clássica, confirmam o diagnóstico13
.
Quando os resultados de 17-OH-progesterona basais são indeterminados, teste de estímulo com 250 mg/ml de
ACTH ou testagem por biologia molecular são opções para complementação da avaliação1
.
Forma não clássica
Valores de 17-OH-progesterona > 0,8 ng/ml em crianças e > 2 ng/ml em mulheres adultas (dosados
durante a fase folicular do ciclo menstrual) sugerem o diagnóstico. Nestes casos, teste de estímulo com 250 mg
deACTH, com dosagem de 17-OH-progesterona > 10 ng/ml, confirma o diagnóstico14
.
358Hiperplasia Adrenal Congênita
Hiperplasia Adrenal Congênita
5 CRITÉRIOS DE INCLUSÃO
• para uso de glicocorticoides
Serão incluídos neste protocolo de tratamento os pacientes com diagnóstico de HAC clássica
com ou sem deficiência mineralocorticoide, feito através de dosagem de 17-OH-progesterona em
amostra de sangue periférico com valores > 100 ng/ml (basal ou após estímulo com 250 mg deACTH).
• para uso de mineralocorticoide
Serão incluídos neste protocolo de tratamento os pacientes com diagnóstico de deficiência
mineralocorticoide (forma perdedora de sal) que apresentarem, além da dosagem de 17-OHprogesterona em amostra de sangue periférico com valores > 100 ng/ml (basal ou após estímulo
com 250 mg de ACTH), quadro clínico e dosagem de sódio e potássio séricos ou renina plasmática e
aldosterona com os seguintes resultados:
− hiponatremia (sódio < 135 mEq/l) e hiperpotassemia (potássio > 5,5 mEq/l);
− renina plasmática acima do valor de referência e aldosterona abaixo do valor de referência.
6 CRITÉRIOS DE EXCLUSÃO
Serão excluídos deste protocolo de tratamento os pacientes que apresentarem uma das
condições abaixo:
• resultado de teste do pezinho com 17-OH-progesterona elevada, sem exame confirmatório
em amostra de sangue;
• contraindicação ou intolerância aos medicamentos especificados.
7 CASOS ESPECIAIS
Pacientes do sexo masculino assintomáticos com HAC forma não clássica não necessitam
de tratamento. Para pacientes do sexo feminino deve ser seguido o tratamento proposto no Protocolo
Clínico e Diretrizes Terapêuticas da Síndrome dos Ovários Policísticos e Hirsutismo.
8 COMITÊ DE ESPECIALISTAS/ CENTRO DE REFERÊNCIA
Pacientes com HAC devem ser avaliados periodicamente em relação à eficácia do tratamento
e ao desenvolvimento de toxicidade aguda ou crônica. Recomenda-se o atendimento em Centro de
Referência por facilitar o tratamento, o ajuste das doses e o controle de efeitos adversos.
9 TRATAMENTO
O tratamento tem por objetivo suprir as deficiências de glicocorticoide e mineralocorticoide
e remediar os sinais/sintomas da hiperandrogenemia. O tratamento com contraceptivos orais e
antiandrogênicosdeveobedeceraopropostonoProtocoloClínicoeDiretrizesTerapêuticasdaSíndrome
dos Ovários Policísticos e Hirsutismo. É fundamental, no caso de necessidade de atendimento médico
emergencial, que todo paciente com HAC forma clássica porte consigo identificação (pulseira, corrente
ou cartão) que informe sua condição e que contenha instruções de medidas a serem tomadas1
.
9.1 FÁrmaCos
Glicocorticoides
• Dexametasona: elixir de 0,1 mg/ml; comprimido de 4 mg; solução injetável de 4 mg/ml
• Prednisona: comprimidos de 5 e 20 mg
• Prednisolona: solução oral de 1,34 mg/ml
• Hidrocortisona: solução injetável de 100 e 500 mg
mineralocorticoide
• Fludrocortisona: comprimido de 0,1 mg
359Protocolos Clínicos e Diretrizes Terapêuticas
Na Tabela 1 estão indicadas as potências biológicas dos esteroides sintéticos em relação ao cortisol.
tabela 1 - potências biológicas dos Esteroides sintéticos em relação ao Cortisol
Esteroide Atividade
anti-inflamatória15
Retenção
salina16 Supressão do eixo hipotálamo-hipófise15
Cortisol/hidrocortisona 1 1 1
Fludrocortisona 12 125 12
Prednisona 3 0,8 4
Prednisolona 3 0,8 4
Dexametasona 26 0 17
* Em pessoas sem deficiência enzimática, a produção diária de cortisol é estimada em 7-9 mg/m2
em neonatos17
,
em 6-7 mg/m2
em crianças e adolescentes18 e em 10-15 mg em adultos19
.
9.2 EsQUEmas dE administração
para glicocorticoides
O tratamento com glicocorticoides deve ser feito com a menor dose possível para manter controlados
os níveis de andrógenos. A tentativa de supressão extrema dos níveis de andrógenos leva a excesso de
glicocorticoide, com desenvolvimento da síndrome de Cushing iatrogênica1
. O excesso tanto de andrógenos
(subtratamento) como de glicocorticoides (sobretratamento) tem impacto negativo no crescimento de crianças
com HAC20,21
. O tratamento pode ser realizado com qualquer um dos glicocorticoides listados abaixo.
• Dexametasona: administrada por via oral, intramuscular ou intravenosa, em dose única diária
Dose inicial em crianças: 0,27 mg/m2
/dia22
Dose inicial em adultos: 0,25-0,75 mg/dia
• Prednisona: administrada por via oral, em dose única diária
Dose inicial em crianças: 2,5-4 mg/m2
/dia23
Dose inicial em adultos: 2,5-7,5 mg/dia
• Prednisolona: administrada por via oral, em dose única diária
Dose inicial em crianças: 2-3 mg/m2
/dia23,24
Dose inicial em adultos: 2,5-7,5 mg/dia
• Hidrocortisona: administrada por via intramuscular ou intravenosa
Dose inicial em crianças: 12-18 mg/m2
/dia (em estresse/crise adrenal: 60-100 mg/m2
/dia)1
Dose inicial em adultos: 20 mg/dia (em crise adrenal: 200-300 mg/dia)
Em gestantes com HAC, para evitar a exposição fetal ao glicocorticoide, o tratamento deve ser realizado
de preferência com glicocorticoide metabolizável pela placenta (prednisona, prednisolona ou hidrocortisona).
ATabela 2 apresenta os glicocorticoides usados no tratamento da HAC.
tabela 2 - Glicocorticoides Usados no tratamento da HaC
Esteroide Dose-equivalente em
crianças (mg/m2
/dia)23
Dose-equivalente em
adultos (mg/dia)15
Dose ao
dia
Meia-vida
(horas)15
Via de
administração
Hidrocortisona 10 - 18 20 2 - 4 12 IV, IM
Prednisona 2,5 - 4 5 1 12 - 36 VO
Prednisolona 2 - 3 5 1 12 - 36 VO
Dexametasona 0,27 0,7 1 > 48 IV, IM, VO
IV: intravenoso; IM: intramuscular; VO: via oral
360Hiperplasia Adrenal Congênita
Hiperplasia Adrenal Congênita
• para mineralocorticoide
O tratamento com mineralocorticoide (fludrocortisona) deve ser feito nos pacientes com HAC
formaperdedoradesal,comoobjetivodenormalizaravolemiaecorrigirosdistúrbiosdesódioepotássio.
Em crianças com menos de 6 meses, devido a menor sensibilidade renal aos mineralocorticoides,
pode ser necessário o uso de doses altas de fludrocortisona e administração de 1-3 g/dia de sal
suplementar25
. Após os 6-12 meses de vida, a dose pode ser gradualmente reduzida até se atingir a
dose de manutenção, que normalmente é de 0,1 mg/dia.
• Fludrocortisona: administrada por via oral, em dose única diária
Dose em crianças: 0,1 mg/dia (podendo variar de 0,05-0,3 mg/dia)
Dose em adultos: 0,1 mg/dia (podendo variar de 0,05-0,4 mg/dia)
9.3 tEmpo dE tratamEnto
O tratamento com glicocorticoides e mineralocorticoides deve ser feito ao longo da vida em
pacientes com HAC forma clássica.
9.4 bEnEFíCios EspErados
O tratamento da HAC forma perdedora de sal com fludrocortisona salva a vida de pacientes
afetados.Apesar disso, nestes pacientes, mesmo com o tratamento instituído, quando há problemas de
entendimento da doença e de adesão ao tratamento, o risco de morte por insuficiência adrenal aguda
(crise adrenal) permanece alto26
.
OtratamentodaHACmelhoraopadrãodecrescimentosem,entretanto,normalizá-lo.Pacientes
com HAC tratados adequadamente atingem altura final cerca de 1,5 desvio-padrão (≈ 10 cm) abaixo da
altura prevista27
.
10 MONITORIZAÇÃO
O acompanhamento deve ser feito a cada 3 meses até o primeiro ano de vida e, em crianças
com tratamento adequado, a cada 4-6 meses.
As dosagens de 17-OH-progesterona, androstenediona e testosterona total são realizadas para
acompanhamento da reposição de glicocorticoides, com o objetivo de manter as dosagens de 17-OHprogesterona entre 4-12 ng/ml1
e androstenediona e testosterona total em valores pouco acima do
limite superior do valor de referência. É importante que em todas as consultas sejam avaliados sinais
clínicos de excesso de glicocorticoide, como fragilidade capilar, presença de giba, estrias violáceas,
fácies de lua cheia, fraqueza muscular proximal e hipertensão.Velocidade de crescimento e maturação
óssea merecem especial atenção, devendo a medida da altura fazer parte de todas as consultas de
acompanhamento.A maturação óssea é acompanhada através de realização anual de raio X de mãos
e punhos para estimativa da idade óssea.
Paraacompanhamentodareposiçãodemineralocorticoide,éimportantedosarreninaplasmática
e sódio e potássio séricos. Os objetivos do tratamento são normalizar o sódio (135-145 mEq/l) e o
potássio (3,5-5,5 mEq/l) e não suprimir a renina, mantendo a pressão arterial normal. Supressão de
renina ou hipertensão podem indicar excesso de mineralocorticoide, sendo necessária revisão da dose
de fludrocortisona.
11 ACompanHamEnto pÓs-tratamEnto
O tratamento deve ser contínuo ao longo da vida com intervalo entre consultas, levando em
consideração os dados clínicos, e com a realização de exames laboratoriais conforme sugerido no item
Monitorização.
12 REGULAÇÃO/CONTROLE/AVALIAÇÃO PELO GESTOR
Devem ser observados os critérios de inclusão e exclusão de pacientes neste protocolo, a
duração e a monitorização do tratamento, bem como a verificação periódica das doses prescritas e
dispensadas e a adequação de uso dos medicamentos.
361Protocolos Clínicos e Diretrizes Terapêuticas
13 TERMO DE ESCLARECIMENTO E RESPONSABILIDADE – TER
É obrigatória a informação ao paciente ou a seu responsável legal dos potenciais riscos, benefícios e
efeitos adversos relacionados ao uso dos medicamentos preconizados neste protocolo. O TER é obrigatório ao
se prescrever medicamento do Componente Especializado daAssistência Farmacêutica.
14 REFERÊNCIAS BIBLIOGRÁFICAS
1. Merke DP, Bornstein SR. Congenital adrenal hyperplasia. Lancet. 2005;365(9477):2125-36.
2. Merke DP, Bornstein SR, Avila NA, Chrousos GP. NIH conference. Future directions in the study and
management of congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Ann Intern Med.
2002;136(4):320-34.
3. Pang S, Murphey W, Levine LS, Spence DA, Leon A, LaFranchi S, et al. A pilot newborn screening for
congenital adrenal hyperplasia inAlaska. J Clin Endocrinol Metab. 1982;55(3):413-20.
4. Therrell BL Jr, Berenbaum SA, Manter-Kapanke V, Simmank J, Korman K, Prentice L, et al. Results of
screening 1.9 million Texas newborns for 21-hydroxylase-deficient congenital adrenal hyperplasia. Pediatrics.
1998;101(4 Pt 1):583-90.
5. Pang SY, Clark A. Congenital adrenal hyperplasia due to 21-hydroxylase defieiency: newbom screening and
its relationship to the diagnosis and treatment of the disorder. J Med Screen. 1993;2:105-39.
6. Silveira EL, dos Santos EP, Bachega TA, van der Linden Nader I, Gross JL, Elnecave RH. The actual
incidence of congenital adrenal hyperplasia in Brazil may not be as high as inferred: an estimate based on a
public neonatal screening program in the state of Goiás. J Pediatr Endocrinol Metab. 2008;21(5):455-60.
7. Labarta JI, Bello E, Ruiz-Echarri M, Rueda C, Martul P, Mayayo E, et al. Childhood-onset congenital adrenal
hyperplasia: long-term outcome and optimization of therapy. J Pediatr Endocrinol Metab. 2004;17(Suppl
3):411-22.
8. Speiser PW. Prenatal and neonatal diagnosis and treatment of congenital adrenal hyperplasia. Horm Res.
2007;68(Suppl 5):90-2. Epub 2007 Dec 10.
9. van der Kamp HJ, Oudshoorn CG, Elvers BH, van Baarle M, Otten BJ, Wit JM, et al. Cutoff levels of 17-alpha-
hydroxyprogesterone in neonatal screening for congenital adrenal hyperplasia should be based on gestational
age rather than on birth weight. J Clin Endocrinol Metab. 2005;90(7):3904-7. Epub 2005 Mar 29.
10. Olgemöller B, Roscher AA, Liebl B, Fingerhut R. Screening for congenital adrenal hyperplasia: adjustment
of 17-hydroxyprogesterone cut-off values to both age and birth weight markedly improves the predictive
value. J Clin Endocrinol Metab. 2003;88(12):5790-4.
11. Varness TS, Allen DB, Hoffman GL. Newborn screening for congenital adrenal hyperplasia has reduced
sensitivity in girls. J Pediatr. 2005;147(4):493-8.
12. Gatelais F, Berthelot J, Beringue F, Descamps P, Bonneau D, Limal JM, et al. Effect of single and multiple
courses of prenatal corticosteroids on 17-hydroxyprogesterone levels: implication for neonatal screening of
congenital adrenal hyperplasia. Pediatr Res. 2004;56(5):701-5. Epub 2004 Sep 15.
13. Speiser PW, White PC. Congenital adrenal hyperplasia. N Engl J Med. 2003;349(8):776-88.
14. New MI, Lorenzen F, Lerner AJ, Kohn B, Oberfield SE, Pollack MS, et al. Genotyping steroid 21-hydroxylase
deficiency: hormonal reference data. J Clin Endocrinol Metab. 1983;57(2):320-6.
15. Trikudanathan S, McMahon GT. Optimum management of glucocorticoid-treated patients. Nat Clin Pract
Endocrinol Metab. 2008;4(5):262-71. Epub 2008 Mar 18.
16. Stewart PM. The Adrenal Cortex. In: Larsen PR, Kronenberg H, Melmed S, Polonsky K, eds. Williams
Textbook of Endocrinology. 11th edition. Philadelphia: Saunders (Elsevier); 2008. p. 491-551.
17. Metzger DL, Wright NM, Veldhuis JD, Rogol AD, Kerrigan JR. Characterization of pulsatile secretion and
clearance of plasma cortisol in premature and term neonates using deconvolution analysis. J Clin Endocrinol
Metab. 1993;77(2):458-63.
18. Linder BL, Esteban NV, Yergey AL, Winterer JC, Loriaux DL, Cassorla F. Cortisol production rate in childhood
and adolescence. J Pediatr. 1990;117(6):892-6.
19. Esteban NV, Loughlin T, Yergey AL, Zawadzki JK, Booth JD, Winterer JC, et al. Daily cortisol production rate
in man determined by stable isotope dilution/mass spectrometry. J Clin Endocrinol Metab. 1991;72(1):39-45.
20. Elnecave RH, Kopacek C, Rigatto M, Brenner JK, de Castro JAS. Bone mineral density in girls with classical
362Hiperplasia Adrenal Congênita
Hiperplasia Adrenal Congênita
congenital adrenal hyperplasia due to CYP21 deficiency. J Pediatr Endocrinol Metab. 2008;21(12):1155-62.
21. Rasat R, Espiner EA,Abbott GD. Growth patterns and outcomes in congenital adrenal hyperplasia; effect of
chronic treatment regimens. N Z Med J. 1995;108(1005):311-4.
22. Rivkees SA, Crawford JD. Dexamethasone treatment of virilizing congenital adrenal hyperplasia: the ability
to achieve normal growth. Pediatrics. 2000;106(4):767-73.
23. Kater CE. Hiperplasia adrenal congênita: como diagnosticar e tratar. In: Vilar L, Kater CE, Naves
LA, Cavalcanti N, Lyra R, Moura E, et al., editores. Endocrinologia clínica. 3a ed. Rio de Janeiro:
Guanabara Koogan; 2006. p. 451-8.
24. Punthakee Z, Legault L, Polychronakos C. Prednisolone in the treatment of adrenal insufficiency:
a re-evaluation of relative potency. J Pediatr. 2003;143(3):402-5.
25. Joint LWPES/ESPE CAH Working Group. Consensus statement on 21-hydroxylase deficiency from
the Lawson Wilkins Pediatric Endocrine Society and the European Society for Paediatric
Endocrinology. J Clin Endocrinol Metab. 2002;87(9):4048-53.
26. Swerdlow AJ, Higgins CD, Brook CG, Dunger DB, Hindmarsh PC, Price DA, et al. Mortality in
patients with congenital adrenal hyperplasia: a cohort study. J Pediatr. 1998;133(4):516-20.
27. Eugster EA, Dimeglio LA, Wright JC, Freidenberg GR, Seshadri R, Pescovitz OH. Height outcome
in congenital adrenal hyperplasia caused by 21-hydroxylase deficiency: a meta-analysis. J Pediatr.
2001;138(1):26-32
1 METODOLOGIA DE BUSCA DA LITERATURA
Utilizando-se como estratégia de busca no Medline/Pubmed os termos “Adrenal Hyperplasia,
Congenital”[Mesh] e “Diagnosis”[Mesh]) e “Therapeutics”[Mesh] e restringindo-se para artigos em humanos
publicados nos últimos 10 anos, resultaram 50 artigos. Na mesma base de dados, utilizando-se a estratégia
de busca “Adrenal Hyperplasia, Congenital”[Mesh] e Clinical Trials e restringindo-se para artigos em humanos
publicados nos últimos 10 anos, foram encontrados outros 50 artigos. Todos os trabalhos foram revisados, e
os 22 identificados como de interesse foram incluídos no protocolo. Também foram consultados livros-texto
de Endocrinologia.
2 INTRODUÇÃO
Adenominação hiperplasia adrenal congênita (HAC) engloba um conjunto de síndromes transmitidas
de forma autossômica recessiva1,2 que se caracterizam por diferentes deficiências enzimáticas na síntese
dos esteroides adrenais. A incidência de HAC é variável entre diferentes populações, com incidência da
forma perdedora de sal variando de 1:2803
a 1:42.000 nascidos vivos4
. No Brasil, a incidência desta forma
parece oscilar de 1:7.5005
a 1:10.000 nascidos vivos6
.As deficiências enzimáticas mais comuns em HAC são:
21-hidroxilase (CYP21A2), que responde por cerca de 95% dos casos2
, e 11-beta-hidroxilase (CYP11B1),
encontrada em aproximadamente 5% dos casos.Ambas estão envolvidas na rota de síntese do cortisol e da
aldosterona. Casos muito raros de HAC por deficiência nas enzimas 20,22-desmolase (CYP11A1), 17-alfahidroxilase (CYP17), 3-beta-hidroxiesteroide-desidrogenase (HSD3B2), aldosterona sintase (CYP11B2) e
hiperplasia lipoide (StAR) podem ocorrer.
As manifestações clínicas das HACs dependem da enzima envolvida e do grau de deficiência
enzimática (total ou parcial). A apresentação clínica pode se expressar por insuficiência glicocorticoide
(deficiência na síntese de cortisol), insuficiência mineralocorticoide (deficiência na síntese da aldosterona) ou
por excesso de andrógenos (desvio da rota de síntese hormonal, com aumento de síntese dos precursores
androgênicos). Em casos de HAC por deficiência das enzimas 11-beta-hidroxilase e 17-alfa-hidroxilase, o
acúmulo dos precursores pregnenolona e progesterona pode ocasionar desvio na rota e aumento na síntese
do mineralocorticoide desoxicorticosterona, com consequente hipertensão e hipopotassemia. As síndromes
clínicas mais frequentes de HAC podem ser divididas em 3 formas: forma clássica perdedora de sal, forma
clássica não perdedora de sal e forma não clássica.
Forma clássica perdedora de sal
Constitui a forma mais comum de HAC clássica (60% dos casos). Nos recém-nascidos do sexo
feminino, há virilização da genitália externa (aumento de clitóris, fusão labial e formação de seio urogenital),
decorrente do excesso de andrógenos durante a vida intrauterina. Nos recém-nascidos do sexo masculino
e nos do sexo feminino nos quais a virilização da genitália externa não foi identificada, como há deficiência
mineralocorticoide, a apresentação ocorre nos primeiros dias de vida com crise adrenal: depleção de volume,
desidratação, hipotensão, hiponatremia e hiperpotassemia.
Consultores: José Miguel Dora, Regina Helena Elnecave, Bárbara Corrêa Krug e Karine MedeirosAmaral
Editores: Paulo Dornelles Picon, Maria Inez Pordeus Gadelha eAlberto Beltrame
Os autores declararam ausência de conflito de interesses.
357Protocolos Clínicos e Diretrizes Terapêuticas
Forma clássica não perdedora de sal (virilizante simples)
Nos recém-nascidos do sexo feminino, há virilização da genitália externa. Como nesta forma não há
deficiênciamineralocorticoidecomrepercussãoclínica,osrecém-nascidosdosexomasculinosãofrequentemente
identificadosemidadetardiapor sinaisde hiperandrogenismo: velocidadedecrescimentoaumentada,maturação
óssea acelerada ou pubarca precoce.
Forma não clássica (de início tardio)
Esta forma de apresentação é cerca de 15 vezes mais frequente do que a forma clássica de HAC7
.
Os pacientes frequentemente são assintomáticos ou as manifestações se apresentam tardiamente na infância
ou adolescência. No sexo feminino, devido ao hiperandrogenismo decorrente da deficiência enzimática, a
apresentação pode ser por aumento de clitóris, pubarca precoce, ciclos menstruais irregulares e hirsutismo. No
sexo masculino, o quadro costuma ser assintomático.
3 ClassiFiCação EstatístiCaintErnaCional dE doEnças E problEmas rElaCionados à
saúdE (Cid-10)
• E25.0 Transtornos adrenogenitais congênitos associados a deficiência enzimática
4 DIAGNÓSTICO
4.1 ClíniCo
Emrecém-nascidosdosexofeminino,odiagnósticodaformaclássicadeHACésuspeitadopelapresença
de virilização da genitália externa. Já em recém-nascidos do sexo masculino, o diagnóstico clínico é dependente
do grau de deficiência mineralocorticoide.Aforma perdedora de sal apresenta-se nos primeiros dias de vida com
desidratação, hipotensão, taquicardia, vômitos, perda de peso, letargia, hiponatremia e hiperpotassemia. No
sexo masculino, a forma não perdedora de sal (virilizante simples) apresenta-se mais tardiamente, com pubarca
precoce, velocidade de crescimento aumentada ou maturação óssea acelerada2
.
O diagnóstico de HAC forma não clássica deve ser considerado em pacientes do sexo feminino com
sintomas ou sinais de hiperandrogenismo. Os do sexo masculino com diagnóstico de HAC forma não clássica
são geralmente assintomáticos. Entretanto, alguns deles, com tecido adrenal ectópico em testículo, podem
apresentar aumento do volume testicular e oligospermia.
4.2 laboratorial
As deficiências enzimáticas de HAC, na síntese do cortisol e da aldosterona, levam ao acúmulo de
metabólitos precursores, dentre os quais 17-OH-progesterona.
Forma clássica
A dosagem de 17-OH-progesterona é utilizada como forma de rastreamento neonatal através do teste
do pezinho8
. Em neonatos, os valores dependem da idade gestacional ao nascimento9
, da idade de coleta do
material para exame10
, do peso ao nascimento10 e do sexo11
. O uso de glicocorticoide antenatal pela mãe, devido
a sua passagem transplacentária, pode suprimir a produção de 17-OH-progesterona no neonato, ocasionando
resultados falso-negativos12
. Os valores de referência para ponto de corte para rastreamento de HAC variam de
15 a 40 ng/ml.
Pacientes com rastreamento positivo para HAC por papel filtro devem confirmar o resultado através de
dosagem de 17-OH-progesterona em sangue periférico. Em neonatos, valores de 17-OH-progesterona < 10 ng/ml
excluem HAC.Pacientes com HACgeralmente apresentam dosagem de 17-OH-progesterona>35 ng/ml, sendo que
resultados acima de 100 ng/ml, vistos na maioria dos pacientes com a forma clássica, confirmam o diagnóstico13
.
Quando os resultados de 17-OH-progesterona basais são indeterminados, teste de estímulo com 250 mg/ml de
ACTH ou testagem por biologia molecular são opções para complementação da avaliação1
.
Forma não clássica
Valores de 17-OH-progesterona > 0,8 ng/ml em crianças e > 2 ng/ml em mulheres adultas (dosados
durante a fase folicular do ciclo menstrual) sugerem o diagnóstico. Nestes casos, teste de estímulo com 250 mg
deACTH, com dosagem de 17-OH-progesterona > 10 ng/ml, confirma o diagnóstico14
.
358Hiperplasia Adrenal Congênita
Hiperplasia Adrenal Congênita
5 CRITÉRIOS DE INCLUSÃO
• para uso de glicocorticoides
Serão incluídos neste protocolo de tratamento os pacientes com diagnóstico de HAC clássica
com ou sem deficiência mineralocorticoide, feito através de dosagem de 17-OH-progesterona em
amostra de sangue periférico com valores > 100 ng/ml (basal ou após estímulo com 250 mg deACTH).
• para uso de mineralocorticoide
Serão incluídos neste protocolo de tratamento os pacientes com diagnóstico de deficiência
mineralocorticoide (forma perdedora de sal) que apresentarem, além da dosagem de 17-OHprogesterona em amostra de sangue periférico com valores > 100 ng/ml (basal ou após estímulo
com 250 mg de ACTH), quadro clínico e dosagem de sódio e potássio séricos ou renina plasmática e
aldosterona com os seguintes resultados:
− hiponatremia (sódio < 135 mEq/l) e hiperpotassemia (potássio > 5,5 mEq/l);
− renina plasmática acima do valor de referência e aldosterona abaixo do valor de referência.
6 CRITÉRIOS DE EXCLUSÃO
Serão excluídos deste protocolo de tratamento os pacientes que apresentarem uma das
condições abaixo:
• resultado de teste do pezinho com 17-OH-progesterona elevada, sem exame confirmatório
em amostra de sangue;
• contraindicação ou intolerância aos medicamentos especificados.
7 CASOS ESPECIAIS
Pacientes do sexo masculino assintomáticos com HAC forma não clássica não necessitam
de tratamento. Para pacientes do sexo feminino deve ser seguido o tratamento proposto no Protocolo
Clínico e Diretrizes Terapêuticas da Síndrome dos Ovários Policísticos e Hirsutismo.
8 COMITÊ DE ESPECIALISTAS/ CENTRO DE REFERÊNCIA
Pacientes com HAC devem ser avaliados periodicamente em relação à eficácia do tratamento
e ao desenvolvimento de toxicidade aguda ou crônica. Recomenda-se o atendimento em Centro de
Referência por facilitar o tratamento, o ajuste das doses e o controle de efeitos adversos.
9 TRATAMENTO
O tratamento tem por objetivo suprir as deficiências de glicocorticoide e mineralocorticoide
e remediar os sinais/sintomas da hiperandrogenemia. O tratamento com contraceptivos orais e
antiandrogênicosdeveobedeceraopropostonoProtocoloClínicoeDiretrizesTerapêuticasdaSíndrome
dos Ovários Policísticos e Hirsutismo. É fundamental, no caso de necessidade de atendimento médico
emergencial, que todo paciente com HAC forma clássica porte consigo identificação (pulseira, corrente
ou cartão) que informe sua condição e que contenha instruções de medidas a serem tomadas1
.
9.1 FÁrmaCos
Glicocorticoides
• Dexametasona: elixir de 0,1 mg/ml; comprimido de 4 mg; solução injetável de 4 mg/ml
• Prednisona: comprimidos de 5 e 20 mg
• Prednisolona: solução oral de 1,34 mg/ml
• Hidrocortisona: solução injetável de 100 e 500 mg
mineralocorticoide
• Fludrocortisona: comprimido de 0,1 mg
359Protocolos Clínicos e Diretrizes Terapêuticas
Na Tabela 1 estão indicadas as potências biológicas dos esteroides sintéticos em relação ao cortisol.
tabela 1 - potências biológicas dos Esteroides sintéticos em relação ao Cortisol
Esteroide Atividade
anti-inflamatória15
Retenção
salina16 Supressão do eixo hipotálamo-hipófise15
Cortisol/hidrocortisona 1 1 1
Fludrocortisona 12 125 12
Prednisona 3 0,8 4
Prednisolona 3 0,8 4
Dexametasona 26 0 17
* Em pessoas sem deficiência enzimática, a produção diária de cortisol é estimada em 7-9 mg/m2
em neonatos17
,
em 6-7 mg/m2
em crianças e adolescentes18 e em 10-15 mg em adultos19
.
9.2 EsQUEmas dE administração
para glicocorticoides
O tratamento com glicocorticoides deve ser feito com a menor dose possível para manter controlados
os níveis de andrógenos. A tentativa de supressão extrema dos níveis de andrógenos leva a excesso de
glicocorticoide, com desenvolvimento da síndrome de Cushing iatrogênica1
. O excesso tanto de andrógenos
(subtratamento) como de glicocorticoides (sobretratamento) tem impacto negativo no crescimento de crianças
com HAC20,21
. O tratamento pode ser realizado com qualquer um dos glicocorticoides listados abaixo.
• Dexametasona: administrada por via oral, intramuscular ou intravenosa, em dose única diária
Dose inicial em crianças: 0,27 mg/m2
/dia22
Dose inicial em adultos: 0,25-0,75 mg/dia
• Prednisona: administrada por via oral, em dose única diária
Dose inicial em crianças: 2,5-4 mg/m2
/dia23
Dose inicial em adultos: 2,5-7,5 mg/dia
• Prednisolona: administrada por via oral, em dose única diária
Dose inicial em crianças: 2-3 mg/m2
/dia23,24
Dose inicial em adultos: 2,5-7,5 mg/dia
• Hidrocortisona: administrada por via intramuscular ou intravenosa
Dose inicial em crianças: 12-18 mg/m2
/dia (em estresse/crise adrenal: 60-100 mg/m2
/dia)1
Dose inicial em adultos: 20 mg/dia (em crise adrenal: 200-300 mg/dia)
Em gestantes com HAC, para evitar a exposição fetal ao glicocorticoide, o tratamento deve ser realizado
de preferência com glicocorticoide metabolizável pela placenta (prednisona, prednisolona ou hidrocortisona).
ATabela 2 apresenta os glicocorticoides usados no tratamento da HAC.
tabela 2 - Glicocorticoides Usados no tratamento da HaC
Esteroide Dose-equivalente em
crianças (mg/m2
/dia)23
Dose-equivalente em
adultos (mg/dia)15
Dose ao
dia
Meia-vida
(horas)15
Via de
administração
Hidrocortisona 10 - 18 20 2 - 4 12 IV, IM
Prednisona 2,5 - 4 5 1 12 - 36 VO
Prednisolona 2 - 3 5 1 12 - 36 VO
Dexametasona 0,27 0,7 1 > 48 IV, IM, VO
IV: intravenoso; IM: intramuscular; VO: via oral
360Hiperplasia Adrenal Congênita
Hiperplasia Adrenal Congênita
• para mineralocorticoide
O tratamento com mineralocorticoide (fludrocortisona) deve ser feito nos pacientes com HAC
formaperdedoradesal,comoobjetivodenormalizaravolemiaecorrigirosdistúrbiosdesódioepotássio.
Em crianças com menos de 6 meses, devido a menor sensibilidade renal aos mineralocorticoides,
pode ser necessário o uso de doses altas de fludrocortisona e administração de 1-3 g/dia de sal
suplementar25
. Após os 6-12 meses de vida, a dose pode ser gradualmente reduzida até se atingir a
dose de manutenção, que normalmente é de 0,1 mg/dia.
• Fludrocortisona: administrada por via oral, em dose única diária
Dose em crianças: 0,1 mg/dia (podendo variar de 0,05-0,3 mg/dia)
Dose em adultos: 0,1 mg/dia (podendo variar de 0,05-0,4 mg/dia)
9.3 tEmpo dE tratamEnto
O tratamento com glicocorticoides e mineralocorticoides deve ser feito ao longo da vida em
pacientes com HAC forma clássica.
9.4 bEnEFíCios EspErados
O tratamento da HAC forma perdedora de sal com fludrocortisona salva a vida de pacientes
afetados.Apesar disso, nestes pacientes, mesmo com o tratamento instituído, quando há problemas de
entendimento da doença e de adesão ao tratamento, o risco de morte por insuficiência adrenal aguda
(crise adrenal) permanece alto26
.
OtratamentodaHACmelhoraopadrãodecrescimentosem,entretanto,normalizá-lo.Pacientes
com HAC tratados adequadamente atingem altura final cerca de 1,5 desvio-padrão (≈ 10 cm) abaixo da
altura prevista27
.
10 MONITORIZAÇÃO
O acompanhamento deve ser feito a cada 3 meses até o primeiro ano de vida e, em crianças
com tratamento adequado, a cada 4-6 meses.
As dosagens de 17-OH-progesterona, androstenediona e testosterona total são realizadas para
acompanhamento da reposição de glicocorticoides, com o objetivo de manter as dosagens de 17-OHprogesterona entre 4-12 ng/ml1
e androstenediona e testosterona total em valores pouco acima do
limite superior do valor de referência. É importante que em todas as consultas sejam avaliados sinais
clínicos de excesso de glicocorticoide, como fragilidade capilar, presença de giba, estrias violáceas,
fácies de lua cheia, fraqueza muscular proximal e hipertensão.Velocidade de crescimento e maturação
óssea merecem especial atenção, devendo a medida da altura fazer parte de todas as consultas de
acompanhamento.A maturação óssea é acompanhada através de realização anual de raio X de mãos
e punhos para estimativa da idade óssea.
Paraacompanhamentodareposiçãodemineralocorticoide,éimportantedosarreninaplasmática
e sódio e potássio séricos. Os objetivos do tratamento são normalizar o sódio (135-145 mEq/l) e o
potássio (3,5-5,5 mEq/l) e não suprimir a renina, mantendo a pressão arterial normal. Supressão de
renina ou hipertensão podem indicar excesso de mineralocorticoide, sendo necessária revisão da dose
de fludrocortisona.
11 ACompanHamEnto pÓs-tratamEnto
O tratamento deve ser contínuo ao longo da vida com intervalo entre consultas, levando em
consideração os dados clínicos, e com a realização de exames laboratoriais conforme sugerido no item
Monitorização.
12 REGULAÇÃO/CONTROLE/AVALIAÇÃO PELO GESTOR
Devem ser observados os critérios de inclusão e exclusão de pacientes neste protocolo, a
duração e a monitorização do tratamento, bem como a verificação periódica das doses prescritas e
dispensadas e a adequação de uso dos medicamentos.
361Protocolos Clínicos e Diretrizes Terapêuticas
13 TERMO DE ESCLARECIMENTO E RESPONSABILIDADE – TER
É obrigatória a informação ao paciente ou a seu responsável legal dos potenciais riscos, benefícios e
efeitos adversos relacionados ao uso dos medicamentos preconizados neste protocolo. O TER é obrigatório ao
se prescrever medicamento do Componente Especializado daAssistência Farmacêutica.
14 REFERÊNCIAS BIBLIOGRÁFICAS
1. Merke DP, Bornstein SR. Congenital adrenal hyperplasia. Lancet. 2005;365(9477):2125-36.
2. Merke DP, Bornstein SR, Avila NA, Chrousos GP. NIH conference. Future directions in the study and
management of congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Ann Intern Med.
2002;136(4):320-34.
3. Pang S, Murphey W, Levine LS, Spence DA, Leon A, LaFranchi S, et al. A pilot newborn screening for
congenital adrenal hyperplasia inAlaska. J Clin Endocrinol Metab. 1982;55(3):413-20.
4. Therrell BL Jr, Berenbaum SA, Manter-Kapanke V, Simmank J, Korman K, Prentice L, et al. Results of
screening 1.9 million Texas newborns for 21-hydroxylase-deficient congenital adrenal hyperplasia. Pediatrics.
1998;101(4 Pt 1):583-90.
5. Pang SY, Clark A. Congenital adrenal hyperplasia due to 21-hydroxylase defieiency: newbom screening and
its relationship to the diagnosis and treatment of the disorder. J Med Screen. 1993;2:105-39.
6. Silveira EL, dos Santos EP, Bachega TA, van der Linden Nader I, Gross JL, Elnecave RH. The actual
incidence of congenital adrenal hyperplasia in Brazil may not be as high as inferred: an estimate based on a
public neonatal screening program in the state of Goiás. J Pediatr Endocrinol Metab. 2008;21(5):455-60.
7. Labarta JI, Bello E, Ruiz-Echarri M, Rueda C, Martul P, Mayayo E, et al. Childhood-onset congenital adrenal
hyperplasia: long-term outcome and optimization of therapy. J Pediatr Endocrinol Metab. 2004;17(Suppl
3):411-22.
8. Speiser PW. Prenatal and neonatal diagnosis and treatment of congenital adrenal hyperplasia. Horm Res.
2007;68(Suppl 5):90-2. Epub 2007 Dec 10.
9. van der Kamp HJ, Oudshoorn CG, Elvers BH, van Baarle M, Otten BJ, Wit JM, et al. Cutoff levels of 17-alpha-
hydroxyprogesterone in neonatal screening for congenital adrenal hyperplasia should be based on gestational
age rather than on birth weight. J Clin Endocrinol Metab. 2005;90(7):3904-7. Epub 2005 Mar 29.
10. Olgemöller B, Roscher AA, Liebl B, Fingerhut R. Screening for congenital adrenal hyperplasia: adjustment
of 17-hydroxyprogesterone cut-off values to both age and birth weight markedly improves the predictive
value. J Clin Endocrinol Metab. 2003;88(12):5790-4.
11. Varness TS, Allen DB, Hoffman GL. Newborn screening for congenital adrenal hyperplasia has reduced
sensitivity in girls. J Pediatr. 2005;147(4):493-8.
12. Gatelais F, Berthelot J, Beringue F, Descamps P, Bonneau D, Limal JM, et al. Effect of single and multiple
courses of prenatal corticosteroids on 17-hydroxyprogesterone levels: implication for neonatal screening of
congenital adrenal hyperplasia. Pediatr Res. 2004;56(5):701-5. Epub 2004 Sep 15.
13. Speiser PW, White PC. Congenital adrenal hyperplasia. N Engl J Med. 2003;349(8):776-88.
14. New MI, Lorenzen F, Lerner AJ, Kohn B, Oberfield SE, Pollack MS, et al. Genotyping steroid 21-hydroxylase
deficiency: hormonal reference data. J Clin Endocrinol Metab. 1983;57(2):320-6.
15. Trikudanathan S, McMahon GT. Optimum management of glucocorticoid-treated patients. Nat Clin Pract
Endocrinol Metab. 2008;4(5):262-71. Epub 2008 Mar 18.
16. Stewart PM. The Adrenal Cortex. In: Larsen PR, Kronenberg H, Melmed S, Polonsky K, eds. Williams
Textbook of Endocrinology. 11th edition. Philadelphia: Saunders (Elsevier); 2008. p. 491-551.
17. Metzger DL, Wright NM, Veldhuis JD, Rogol AD, Kerrigan JR. Characterization of pulsatile secretion and
clearance of plasma cortisol in premature and term neonates using deconvolution analysis. J Clin Endocrinol
Metab. 1993;77(2):458-63.
18. Linder BL, Esteban NV, Yergey AL, Winterer JC, Loriaux DL, Cassorla F. Cortisol production rate in childhood
and adolescence. J Pediatr. 1990;117(6):892-6.
19. Esteban NV, Loughlin T, Yergey AL, Zawadzki JK, Booth JD, Winterer JC, et al. Daily cortisol production rate
in man determined by stable isotope dilution/mass spectrometry. J Clin Endocrinol Metab. 1991;72(1):39-45.
20. Elnecave RH, Kopacek C, Rigatto M, Brenner JK, de Castro JAS. Bone mineral density in girls with classical
362Hiperplasia Adrenal Congênita
Hiperplasia Adrenal Congênita
congenital adrenal hyperplasia due to CYP21 deficiency. J Pediatr Endocrinol Metab. 2008;21(12):1155-62.
21. Rasat R, Espiner EA,Abbott GD. Growth patterns and outcomes in congenital adrenal hyperplasia; effect of
chronic treatment regimens. N Z Med J. 1995;108(1005):311-4.
22. Rivkees SA, Crawford JD. Dexamethasone treatment of virilizing congenital adrenal hyperplasia: the ability
to achieve normal growth. Pediatrics. 2000;106(4):767-73.
23. Kater CE. Hiperplasia adrenal congênita: como diagnosticar e tratar. In: Vilar L, Kater CE, Naves
LA, Cavalcanti N, Lyra R, Moura E, et al., editores. Endocrinologia clínica. 3a ed. Rio de Janeiro:
Guanabara Koogan; 2006. p. 451-8.
24. Punthakee Z, Legault L, Polychronakos C. Prednisolone in the treatment of adrenal insufficiency:
a re-evaluation of relative potency. J Pediatr. 2003;143(3):402-5.
25. Joint LWPES/ESPE CAH Working Group. Consensus statement on 21-hydroxylase deficiency from
the Lawson Wilkins Pediatric Endocrine Society and the European Society for Paediatric
Endocrinology. J Clin Endocrinol Metab. 2002;87(9):4048-53.
26. Swerdlow AJ, Higgins CD, Brook CG, Dunger DB, Hindmarsh PC, Price DA, et al. Mortality in
patients with congenital adrenal hyperplasia: a cohort study. J Pediatr. 1998;133(4):516-20.
27. Eugster EA, Dimeglio LA, Wright JC, Freidenberg GR, Seshadri R, Pescovitz OH. Height outcome
in congenital adrenal hyperplasia caused by 21-hydroxylase deficiency: a meta-analysis. J Pediatr.
2001;138(1):26-32
quarta-feira, 29 de maio de 2013
CÂNCER NO CÉREBRO
O que é Tumor cerebral?
Tumor cerebral é o crescimento anormal de células dentro do crânio que leva à compressão e lesão de células normais do cérebro. Podem ser "benignos" ou malignos, sendo que apenas os tumores malignos são denominados de câncer.
Geralmente esses tumores podem ser divididos em duas categorias:
- Tumor cerebral primário: quando o tumor tem origem dentro do próprio crânio
- Tumor metastático, metástase ou tumor cerebral secundário: quando o tumor tem origem em outro órgão e se espalha pelo corpo.
Causas
As causas são variadas e muitas vezes desconhecidas. Quando a pessoa tem um tumor no pulmão, por exemplo, algumas células dessa lesão podem cair na corrente sanguínea e se instalar em qualquer parte do organismo, inclusive no cérebro.
 Ilustração do cérebro humano
Ilustração do cérebro humano
O cérebro é composto, resumidamente, pelos hemisférios cerebrais, o cerebelo (em azul, na figura), e tronco cerebral (que sustenta todo o cérebro); o revestimento do cérebro e da medula espinhal é feito pelas meninges, que são duas membranas, uma grudada ao cérebro, a outra ao crânio (por dentro) entre as quais corre um líquido, denominado de líquor.
De acordo com o Instituto Nacional de Câncer (INCA), no Brasil, 4% das mortes por câncer no Brasil estão relacionadas com os tumores cerebrais. Nos Estados Unidos, 1 em cada 5 mil pessoas desenvolve um tumor cerebral ao longo da vida. Além dos tumores próprios do cérebro, 25% dos tumores de origem em outras regiões do corpo dão metástases (se espalham) no cérebro.
Tipos
Existem quase 100 tipos de tumores cerebrais, que geralmente recebem o nome do tipo da célula da qual se desenvolve. A maioria dos tumores no cérebro origina-se nas células gliais, que sustentam as células nervosas do órgão. Um tumor de células gliais é denominado glioma.
Os tumores cerebrais são classificados em grupos e de acordo com a rapidez com que se desenvolvem. Como regra geral, o tumor de menor grau é considerado menos agressivo, enquanto o de maior grau é o mais agressivo.
O tumor menos agressivo, geralmente é:
- De crescimento relativamente lento
- Improvável que retorne, em caso de remoção completa
- Improvável que tenha se espalhado para outras regiões
- Pode apenas necessitar de cirurgia.
Já para um tumor agressivo, geralmente:
- Cresce relativamente rápido
- É provável que retorne após a cirurgia, mesmo que completamente removido
- Pode apresentar metástase em outras regiões
- Não podem ser tratados apenas cirurgicamente, são necessários os tratamentos radioterápicos e quimioterápicos para evitar a recidiva.
 Ilustração de um tumor no cérebro
Ilustração de um tumor no cérebroMeningiomas
Os meningiomas representam 25 % dos tumores cerebrais, sendo mais comuns em pessoas mais velhas e em mulheres, normalmente provenientes das meninges do cérebro e medula espinhal e frequentemente encontrados na parte frontal ou posterior do cérebro
Alguns meningiomas são atípicos, isto é, seu comportamento é mais agressivo que o esperado para meningiomas. Eles podem crescer em torno do tecido cerebral e retornar após a sua remoção. Os sintomas dos meningiomas variam muito, dependendo de onde no cérebro estão crescendo. Mais comum em adultos de meia idade, especialmente mulheres.
Gliomas
Mais da metade dos tumores cerebrais em adultos são gliomas, que estão divididos em três tipos:
1. Astrocitoma
É o tipo mais comum de glioma a se desenvolver a partir de células denominadas astrócitos. Os astrocitomas podem ser de crescimento lento ou rápido. Alguns são bem localizados (focal), o que significa dizer que é fácil identificar o limite entre o tumor e o tecido cerebral normal num exame de imagem ou mesmo durante uma cirurgia.
Outros tipos de Astrocitomas são chamados difusos. Esses não têm um limite claro entre o tumor e o tecido normal do cérebro. No interior do tumor pode-se desenvolver um astrocitoma com maior malignidade. Os tipos de tumores cerebrais mais comuns em adultos são o Astrocitoma Anaplásico e o Glioblastoma Multiforme. A remoção completa por cirurgia é possível se o tumor estiver no início do seu desenvolvimento.
2.Ependinoma
Aproximadamente 6% dos tumores cerebrais são Ependinomas, que se desenvolvem a partir das células ependimais e do quarto ventrículo. Estas células forram as áreas preenchidas pelo fluído do cérebro (os ventrículos) e espinha dorsal. Lesões primárias também podem se desenvolver na medula espinhal. A maioria dos ependinomas são diagnosticados em crianças ou adolescentes. Ocasionalmente os ependinomas podem apresentar metástase dentro do sistema nervoso central, pelo contato com o líquor.
3. Oligodendroglioma
Cerca de 5% dos tumores cerebrais são oligodendrogliomas, que se desenvolvem a partir das células da oligodendroglia, células de sustentação do tecido cerebral. Os oligodendrogliomas são mais frequentemente encontrados na parte frontal do cérebro, no lóbulo temporal ou frontal, podendo ser de crescimento rápido. São mais frequentes em adultos, mas não é incomum em crianças.
Meduloblastoma
Meduloblastoma é o tipo mais comum de PNET (Tumor neuroectodermal) que cresce no cerebelo, corresponde de 15% a 20% de todos os tumores cerebrais em crianças, mais frequente entre os 5 a 9 anos. Afeta mais meninos do que meninas, 30% ocorrem em jovens adultos. São tumores que podem se desenvolver rapidamente, espalhando-se para outras partes do Sistema Nervoso pelo líquido cefalorraquidiano (LCR).
Tumores da Hipófise
A hipófise, localizada na base do crânio, controla grande parte do sistema endócrino do corpo. Usualmente, os tumores da hipófise são benignos e secretam quantidades excessivas de hormônios: o aumento do hormônio do crescimento acarreta uma estatura extrema (gigantismo) ou um crescimento desproporcional da cabeça, rosto, mãos, pés e tórax (acromegalia), o aumento de corticotropina resulta na Síndrome de Cushing, o aumento do hormônio estimulante da tireoide acarreta o hipertireoidismo, o aumento de prolactina interrompe os períodos menstruais (amenorreia), causa produção de leite na mama de mulheres que não estão amamentando (galactorreia) e causa crescimento das mamas em homens (ginecomastia).
Os tumores da hipófise também podem destruir tecidos secretores de hormônios, o que finalmente traz consigo níveis insuficientes de hormônios no organismo. Outros sintomas podem incluir dor de cabeça e perda dos campos visuais externos de ambos os olhos.
Craniofaringioma
Os craniofaringiomas são tumores que crescem na base do cérebro, logo acima da hipófise e são frequentemente diagnosticados em crianças, adolescentes e adultos jovens. Eles não costumam se espalhar, mas estão perto de estruturas importantes no cérebro e podem causar problemas à medida que se desenvolvem. Os craniofaringiomas podem causar alterações na visão e desequilíbrio hormonal. Crianças com craniofaringioma podem ser obesas e apresentarem problemas de crescimento.
Hemangioblastoma
Cerca de 2% dos tumores cerebrais são Hemangioblastomas. Estes tumores crescem a partir de células dos vasos sanguíneos, mas podem se desenvolver no tronco cerebral.
Neuroma Acústico
Este tumor cresce no nervo auditivo que controla a audição e o equilíbrio localizado entre o cerebelo e a ponte. Geralmente é de crescimento lento, não se espalha e é encontrado com mais frequência em pessoas de meia idade, duas vezes mais em mulheres do que em homens. A perda de audição em um dos ouvidos pode ser um sinal de neuroma acústico.
Tumores da Região Pineal
A glândula pineal ou epífise está no meio do cérebro, logo atrás da parte superior do tronco cerebral, e produz a melatonina. Estes tumores são raros, apenas 1% dos tumores cerebrais diagnosticados são tumores da glândula pineal. Vários tipos diferentes de tumores podem crescer na região pineal, incluindo gliomas. Os tipos mais comuns são chamados de tumores de células germinativas.
Tumores da Medula Espinhal
São tumores raros do sistema nervoso central e estão localizados na medula, são capazes de comprometer varias funções dependendo da localização podendo causar dor, dormência, formigamento e fraqueza, espasmos, fraqueza, má coordenação e diminuição ou alterações da sensibilidade. O tumor também pode causar dificuldade miccional, incontinência urinária ou constipação intestinal. Muitos tumores podem ser removidos cirurgicamente.
Linfomas
Ocasionalmente, os linfomas se iniciam no cérebro, e são chamados de linfoma cerebral. Podem ser múltiplos. Os sintomas iniciais podem ser alterações na personalidade e convulsões ou alterações neurológicas. Os fatores de risco são a AIDS ou a imunossupressão como a que ocorre no câncer, transplante de órgãos ou tratamento de desordens autoimunes. A incidência é de 3 pessoas em cada 1 milhão.
Fatores de risco
O câncer do sistema nervoso central (que inclui o cérebro e a medula espinhal), assim como os cânceres de outros órgãos, é causado por anormalidades (mutações) dos genes nesse tecido. Embora a grande maioria dos casos ocorra ao acaso, há alguns fatores relacionados a um risco aumentado para estas mutações, e consequentemente para o câncer do SNC.
- Gênero: o câncer do SNC é mais comum em homens do que em mulheres
- Idade: embora possa desenvolver-se em qualquer idade, é mais comum nos idosos (acima de 65 anos)
- Radiação: ocorre com maior frequência em pessoas que fizeram tratamento de radioterapia na cabeça anteriormente
- É mais frequente em pessoas que tenham passado por tratamento de leucemia durante a infância
- Exposição ao cloreto de vinil (utilizado na produção de plástico)
- Pacientes com baixa imunidade
- Pacientes com infecções pelo HIV.
- Sintomas de Tumor cerebral
Tumores do cérebro afetam diferentes funções e podem causar diferentes sintomas:
- Dor de cabeça, náuseas e vômitos persistentes
- Alterações visuais e auditivas
- Convulsão
- Agitação motora
- Fraqueza ou rigidez muscular
- Perda de sensibilidade em qualquer parte do corpo
- Falta de coordenação
- Dificuldade para falar ou entender o que é dito
- Esquecimento das palavras
- Problemas com leitura e escrita de modo inexplicável
- Movimentos involuntários
Diagnóstico de Tumor cerebral
O diagnóstico começa na própria consulta na qual o médico faz um levantamento do histórico do paciente e dos dados necessários para determinar se há probabilidade de ser ou não um tumor. A seguir, deverá realizar um exame neurológico, que permite a avaliação das funções nervosas e suas alterações.
O médico suspeita de um tumor cerebral quando o paciente apresenta um conjunto de sintomas característicos. Nesse caso ele deverá pedir exames complementares, tais como: eletroencefalograma, tomografia computadorizada, ressonância magnética, entre outros. Radiografias simples do crânio e do cérebro não ajudam muito no diagnóstico da grande maioria de tumores cerebrais.
O tumor cerebral pode ser identificado em uma tomografia computadorizada ou ressonância magnética. Esses dois exames podem dimensionar o tumor e indicar a sua exata localização, entretanto outros devem ser realizados para que maiores detalhes sobre o tumor possam ser avaliados.
Tomografia Computadorizada e Ressonância Magnética
A Tomografia Computadorizada utiliza raios X e um computador de varredura que reproduz imagens realçadas do cérebro. A Ressonância Magnética combina um forte magnetismo e ondas de rádio para reproduzir imagens realçadas do cérebro.
Biópsia Estereotáxica
Durante a biópsia, uma amostra do tumor é retirada e examinada em laboratório para determinar se é benigno ou maligno. A biópsia estereostática é normalmente utilizada quando o tumor está em uma parte do cérebro difícil de ser alcançada. Geralmente utiliza-se uma estrutura especial para ajudar a segurar a cabeça do paciente. Depois de aplicada uma anestesia local, o cirurgião irá inserir uma agulha estreita através do crânio até chegar ao tumor e remover células tumorais para exame em laboratório.
Tratamento de Tumor cerebral
Nem todos os tumores cerebrais são câncer, mas como o crânio é uma "caixa fechada", mesmo os tumores benignos do SNC podem ser muito graves, pois comprimem estruturas vitais do cérebro.
O tratamento do tumor cerebral é feito de modo multidisciplinar, com a decisão conjunta entre um neurocirurgião, um radioterapêuta, um oncologista, e frequentemente um neurologista.
A combinação individualizada das diversas modalidades de tratamento (cirurgia, radioterapia, tratamento sistêmico) oferece as melhores possibilidades terapêuticas aos pacientes.
Tratamento cirúrgico
O tratamento cirúrgico de um tumor cerebral depende, essencialmente, de sua localização e tipo; muitos tumores cerebrais podem ser removidos sem causar lesão no tecido cerebral normal, contudo, alguns se desenvolvem em uma área que torna a remoção difícil, pois estruturas essenciais podem ser comprometidas.
A ressecção de um tumor é necessária se o seu crescimento afetar estruturas cerebrais importantes; mesmo em casos em que a cirurgia não seja curativa, o procedimento poderá ser útil para reduzir o tamanho do tumor, aliviar os sintomas e permitir ao médico determinar de que tipo de tumor se trata e se outro tipo de tratamento poderia ser adequado.
Tratamento sistêmico (inclui o quimioterápico)
O tratamento pode ser feito apenas com medicamentos ou em combinação com outros tipos de tratamentos, como a cirurgia ou radioterapia.
A quimioterapia ataca as células tumorais, mas também as células normais. Por isso, é frequente aparecerem efeitos colaterais. Pode ser administrada por via intravenosa, por via oral ou ainda por um implante no cérebro.
Recentemente vem-se usando medicações que inibem o crescimento dos vasos que nutrem o tumor. São os chamados anti-angiogênicos.
 Tratamento de radioterapia para tumor no cérebro
Tratamento de radioterapia para tumor no cérebroTratamento radioterápico
A radioterapia pode ser usada isoladamente ou em combinação com cirurgia, quimioterapia ou ambos. Quimioterápicos podem ser utilizados como drogas radiosensibilizantes, que tornam as células tumorais mais sensíveis à radiação.
É estritamente essencial um equipamento moderno de radioterapia, para tratar de maneira adequada o tecido tumoral, poupando ao máximo o tecido cerebral em volta.
Tratamento das metástases
O tratamento das metástases cerebrais depende em grande medida da região onde se originou o tumor. Muitas vezes, ser realiza radioterapia para tratar metástases cerebrais.
O tratamento cirúrgico pode ser útil em caso de existirem apenas uma ou duas metástase, desde que a doença esteja controlada no restante do corpo. Outros tratamentos podem ser realizados e incluem quimioterapia, colocação de implantes radioativos dentro do tumor e radiocirurgia.
terça-feira, 28 de maio de 2013
TIPOS DE DE NANISMO
O que é o Nanismo?
O Nanismo é uma doença genética que provoca um crescimento esquelético anormal, resultando num indivíduo cuja altura é muito menor que a altura média de toda a população. No estado adulto, um anão tem cerca de 1m a 1,20m de altura.
A partir da morfologia, o Nanismo está dividido em dois grandes grupos:
- Nanismo Pituitário ou Nanismo Proporcional (é causado por alterações hormonais) – o indivíduo tem uma estatura baixa e o tamanho dos seus órgãos mantém a mesma proporção;
- Nanismo Rizomélico ou Nanismo Desproporcional (é causado por mutaçõesgenéticas) – também designado por Displasia Esquelética. O tamanho do indivíduo é muito mais baixo que o normal e alguns dos seus órgão têm um tamanho maior em relação à altura.
Visto que o nosso trabalho está relacionado com a genética iremos falar apenas sobre o Nanismo Desproporcional.
Dentro do grande grupo de Nanismo Desproporcional, encontram-se dois tipos de Nanismo muito semelhantes e mais comuns:
- Acondroplasia: É o tipo de Nanismo mais comum, que pode ou não ser transmitida de pais para filhos. Trata-se de uma desordem genética de carácter congénito que afecta o crescimento do esqueleto, sendo evidente ao nascimento. Esta patologia pode ter um carácter autossómico dominante, isto é, se a criança herdar o gene anormal de um dos progenitores, manifestará a doença. Contudo, aproximadamente 80% dos casos desenvolvem-se devido a mutações espontâneas. E cerca de 97% dos pacientes com acondroplasia apresentam a mesma mutação, uma transição G – A, levando à substituição de uma Glicina por Arginina no domínio transmembranar do receptor do factor de crescimento fibroblástico 3 (FGFR3).
- Hipocondroplasia: É uma displasia esquelética caracterizada por um crescimento anormal dos ossos que resulta em indivíduos com baixa estatura e com braços e pernas desproporcionalmente pequenos. O quadro clínico é semelhante ao da acondroplasia mas tende a ser mais atenuado. Esta patologia é herdada de forma autossómica dominante, sendo que 70% dos indivíduos afectados possuem uma substituição do aminoácido asparagina por uma lisina.
Manifestação da Doenças
A hereditariedade da acondroplasia e de hipocondroplasia manifesta-se de forma autossómica dominante.
- Cerca de 75% dos doentes com acondroplasia/hipocondroplasia apresentam novas mutações, o que explica que a maioria dos doentes tenha pais normais;
- Para pais não afectados com acondroplasia/hipocondroplasia, o risco de recorrência será inferior a 1%;
- Quando um dos pais tem acondroplasia/hipocondroplasia a probabilidade de se manifestar na geração seguinte é de 50%;
- E quando ambos os pais têm acondroplasia/hipocondroplasia, existe um risco de 50% de terem um filho com acondroplasia, 25% de terem um filho com uma forma deacondroplasia homozigótica letal e 25% de terem um filho de «estatura normal».
Características de um portador de Acondroplasia
e Hipocondroplasia
- Estatura baixa;
- Membros curtos (braços e coxas);
- Anormalidades esqueléticas;
- Aparência da mão anormal, dedos engrossados com espaço persistente entre os dedos média e anelar;
- Testa saliente;
- Cabeça grande e desproporcional ao corpo;
- Hipotonia (o tonus muscular está anormalmente baixo, geralmente envolvendo redução da força muscular);
- Pernas tortas;
- Estenose (é um estreitamento anormal de um vaso sanguíneo, de um órgão ou da estrutura tubular do corpo).
Diagnóstico
O diagnóstico desta patologia é feito através da análise de radiografias do esqueleto do indivíduo; o diagnóstico pré-natal é possível ser realizado por ultra-sonografia, mas o ideal é a confirmação por testes de DNA em células do líquido amniótico.
Hoje, já existem testes de DNA que permitem o diagnóstico de certeza da acondroplasia e da hipocondroplasia. Porém, algumas das displasias esqueléticas mais graves são incompatíveis com a vida extra-uterina e os bebés falecem logo após o parto.
Tratamento e Prevenção das Complicações
Os bebés e crianças com acondroplasia devem ser seguidos por um médico com experiência nesta desordem, pois podem existir anormalidades esqueléticas. A detecção destas anormalidades é bastante importante porque estas podem causar:
- Compressão da medula espinal;
- Dificuldade em respirar;
- Dor nas pernas e a perda da sua função.
Outro sintoma que estas crianças podem apresentar é a cifose (corcunda) que, se não desaparecer depois de a criança começar a caminhar, pode ser corrigida por um aparelho ortopédico para as costas ou por cirurgia. A correcção cirúrgica das anomalias ósseas da perna, por exemplo, pode reduzir o grau de deformação das pernas curtas.
Existem muitos outros factores que necessitam do acompanhamento médicos, como, por exemplo:
- O perímetro cefálico e o desenvolvimento psicomotor devem ser comparados com tabelas específicas para que alterações destes parâmetros sejam diagnosticadas precocemente;
- Os médicos que acompanham um indivíduo com nanismo devem alertar os pais para a possibilidade de ocorrerem apneias;
- A avaliação da audição deve ser realizada anualmente até aos 3-4 anos, por causa das otites frequentes e da possibilidade de perda de audição.
A Acondroplasia não tem cura nem prevenção, mas existem tratamentos que minimizam os sintomas:
- Na maioria dos casos de Nanismo Proporcional, a reposição da hormona de crescimento é uma das alternativas;
- O alongamento ósseo é um dos processos que o portadores de Nanismo Desproporcional, e não só, recorrem. Tem como objectivo a correcção dos membros inferiores e eventualmente dos superiores.
CISTO DE TARLOV
Perineurais cistos (ou Tarlov) são cheias de líquido cefalorraquidiano nervosas cistos radiculares mais comumente encontrados no nível sacral da coluna vertebral, embora possam ser encontradas em qualquer parte da coluna, que pode causar radiculopatia progressivamente dolorosa. A incidência anual de cistos perineurais é estimado em cerca de 5%, apesar de grandes cistos, que causam sintomas são relativamente raros, com incidência anual estimada em menos de 1/2, 000. As mulheres são afetadas com mais freqüência do que os homens. Pacientes com cistos perineurais apresentar dor na região dos nervos afetados pelo cisto, fraqueza muscular, dificuldade sentado por períodos prolongados, perda de sensibilidade, perda de reflexos, dores ao espirrar ou tossir, inchaço sobre a área sacral, parestesia, dores de cabeça , ciática, e do intestino, bexiga e disfunção sexual. Os cistos geralmente ocorrem ao longo das raízes nervosas posteriores e podem ser valvulados ou nonvalved. A principal característica que distingue os cistos perineurais de outras lesões da coluna vertebral é a presença de fibras de raízes nervosas da coluna vertebral dentro da parede do cisto ou na cavidade do cisto. A maioria dos cistos perineurais são esporádicas. No entanto, em alguns casos, os cistos foram observadas entre parentes, sugerindo a possibilidade de um traço familiarizados com transmissão autossómica. Há um certo número de condições que podem causar os cistos para se tornar sintomático, incluindo lesão traumática, pesado, parto, epidurais, e trauma da medula espinhal. Também tem sido observado que o vírus herpes simplex podem causar a química do corpo para mudar e que os sintomas de quisto perineurais piorar durante os surtos de vírus do herpes. O diagnóstico é baseado na ressonância magnética (MRI), topografia computadorizada (TC) ou mielograma de pacientes com dor lombar ou ciática. Os principais diagnósticos diferenciais são divertículos meninges e prolongamentos aracnóide longos, que podem ser distinguidas por um enchimento rápido em comparação com a mielografia enchimento retardada de cistos perineurais. Os diagnósticos diferenciais incluem também discos lombares, hérnia de aracnoidite e, nas fêmeas, condições ginecológicas. O tratamento envolve a drenagem lombar do líquido cefalorraquidiano, tomografia computadorizada guiada aspiração do cisto, laminectomia descompressiva, cisto e / ou nervo excisão raiz e microcirúrgica cisto fenestração e imbricações. No entanto, o tratamento cirúrgico de cistos perineurais é complicada por pseudomeningocoele pós-operatório e hipotensão intracraniana, e recorrência do cisto. A terapia da dor podem oferecer uma alternativa não cirúrgica para o tratamento de cistos perineurais sintomáticos.Aqueles que têm sintomas progressivos e prolongada podem sofrer danos neurológicos se os cistos continuar a comprimir as estruturas nervosas.